Обычная концентрация О2 превышает оптимальную для фотосинтеза величину. У растений с высоким уровнем фотодыхания (бобы и др.) уменьшение концентрации кислорода с 21 до 3% усиливало фотосинтез, а у растений кукурузы (с низким уровнем фотодыхания) такого рода изменение не влияло на интенсивность фотосинтеза.
Высокие концентрации О2 (25 — 30%) снижают фотосинтез («эффект Варбурга»). Предложены следующие объяснения этого явления. Повышение парциального давления О2 и уменьшение концентрации СО2 активируют фотодыхание (см. 3.4.4). Кислород непосредственно снижает активность РДФ-карбоксилазы. Наконец, О2 может окислять первичные восстановленные продукты фотосинтеза.
Суточные и сезонные ритмы фотосинтеза. Исследования фотосинтеза растений естественных наземных экосистем были начаты в первой четверти XX в. работами В. Н. Любименко, С. П. Костычева и др. Факторы внешней среды, рассмотренные ранее, действуют совместно и в различных сочетаниях. Однако решающую роль играют свет, температура и водный режим.
|
|
|
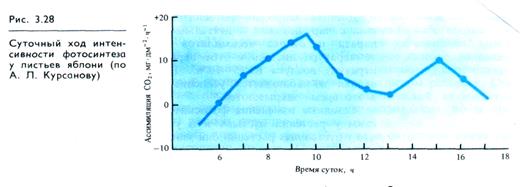
С восходом солнца интенсивность фотосинтеза возрастает вместе с освещенностью, достигая максимальных значений в 9—12 ч (рис. 3.28). Дальнейший характер процесса определяется степенью оводненности листьев, температурой воздуха и интенсивностью солнечного света. В полуденные часы интенсивность фотосинтеза не увеличивается: она может оставаться примерно на уровне утреннего максимума (в нежаркие, облачные дни) или несколько снижаться, но тогда к 16—17 ч наблюдается повторное усиление процесса. Интенсивность фотосинтеза падает после 22 ч с заходом солнца.
Дневная депрессия фотосинтеза (если имеет место) связана с нарушениями в деятельности фотосинтетического аппарата и оттока ассимилятов при перегреве, поскольку температура листьев в этот период может превышать температуру воздуха на 5— 10°С. Если потери воды тканями велики и наблюдается усиление фотодыхания, то устьица в это время закрываются.
Сезонные изменения фотосинтеза, изученные О. В. Заленским у растений пустынь и в условиях Арктики, показали, что у пустынных растений они зависят от особенностей онтогенеза, а у эфемеров с коротким вегетационным периодом максимальные интенсивности фотосинтеза наблюдаются в конце марта — середине апреля и совпадают с началом плодоношения. У растений, заканчивающих активную вегетацию в начале лета, сезонный максимум фотосинтеза отмечается перед наступлением летнего покоя. У длительно вегетирующих деревьев и кустарников сезонный максимум регистрируется в самом начале жаркого и сухого периода. К осени интенсивность фотосинтеза постепенно снижается. У арктических растений сезонные изменения фотосинтеза проявляются в снижении его интенсивности в начале и в конце периода вегетации, когда растения часто подвержены действию заморозков. Максимум фотосинтеза отмечается в наиболее благоприятный период полярного лета.
|
|
|
 Взаимоотношения роста растений и интенсивности фотосинтеза отражают непрерывную перестройку фотосинтетического аппарата в ходе онтогенеза и динамику формирования и активности растущих (аттрагирующих) органов, потребляющих ассимиляты. Начальный этап развития листа осуществляется за счет деления и роста клеток, а затем — лишь путем растяжения. За это время делятся и развиваются хлоропласты, число которых увеличивается, пока растет объем клетки. В клетках губчатой ткани пластид образуется в 1,5 — 2,0 раза меньше (у картофеля около 70), чем в палисадной (200 — 300 органоидов). Новообразование хлоропластов завершается довольно рано, но рост клеток опережает увеличение числа хлоропластов, в результате чего в онтогенезе листа их количество в 1 см2 убывает вдвое. Однако содержание хлорофилла в хлоропласте продолжает увеличиваться и после достижения хлоропластом наибольшей величины. Максимальная интенсивность фотосинтеза наблюдается во время роста клеток листа растяжением и начинает несколько снижаться, когда площадь листа составляет 0,4 — 0,8 от конечной. Затем процесс фотосинтеза может уменьшаться с возрастом листа или не меняется длительное время (особенно у вечнозеленых растений).
Взаимоотношения роста растений и интенсивности фотосинтеза отражают непрерывную перестройку фотосинтетического аппарата в ходе онтогенеза и динамику формирования и активности растущих (аттрагирующих) органов, потребляющих ассимиляты. Начальный этап развития листа осуществляется за счет деления и роста клеток, а затем — лишь путем растяжения. За это время делятся и развиваются хлоропласты, число которых увеличивается, пока растет объем клетки. В клетках губчатой ткани пластид образуется в 1,5 — 2,0 раза меньше (у картофеля около 70), чем в палисадной (200 — 300 органоидов). Новообразование хлоропластов завершается довольно рано, но рост клеток опережает увеличение числа хлоропластов, в результате чего в онтогенезе листа их количество в 1 см2 убывает вдвое. Однако содержание хлорофилла в хлоропласте продолжает увеличиваться и после достижения хлоропластом наибольшей величины. Максимальная интенсивность фотосинтеза наблюдается во время роста клеток листа растяжением и начинает несколько снижаться, когда площадь листа составляет 0,4 — 0,8 от конечной. Затем процесс фотосинтеза может уменьшаться с возрастом листа или не меняется длительное время (особенно у вечнозеленых растений).
На ранних этапах роста (до развертывания 30 — 45% площади) лист сам потребляет ассимиляты из более зрелых листьев или из запасающих тканей. По мере роста листа усиливается транспорт ассимилятов из него в другие листья и органы и постепенно лист становится донором ассимилятов. Эта функция устанавливается при достижении 60 — 90% конечной площади листа. Взрослые листья отдают свои ассимиляты в аттрагирующие зоны растения, оставляя на собственные нужды 10 — 40% ассимилятов и почти не обмениваясь между собой продуктами фотосинтеза. Последнее явление, названное А. Л. Курсановым (1961) «суровым законом», способствует лучшему распределению ассимилятов в целом растении. Стареющие листья со слабой фотосинтетической активностью отдают другим органам не только ассимиляты, но и продукты распада структур цитоплазмы.
 Такого рода смена функций листа в онтогенезе важна при формировании урожая. Потребление ассимилятов молодым листом приводит к построению добавочного фотосинтетического аппарата, чем обеспечивается увеличение фотосинтетической активности в геометрической прогрессии. Следует отметить также, что в онтогенезе изменяется соотношение путей фотосинтетического метаболизма. В условиях, когда внешние факторы не лимитируют скорость фотосинтеза, этот процесс целиком детерминируется ростовой функцией (А. Т. Мок-роносов, 1981).
Такого рода смена функций листа в онтогенезе важна при формировании урожая. Потребление ассимилятов молодым листом приводит к построению добавочного фотосинтетического аппарата, чем обеспечивается увеличение фотосинтетической активности в геометрической прогрессии. Следует отметить также, что в онтогенезе изменяется соотношение путей фотосинтетического метаболизма. В условиях, когда внешние факторы не лимитируют скорость фотосинтеза, этот процесс целиком детерминируется ростовой функцией (А. Т. Мок-роносов, 1981).
Современные знания о процессе фотосинтеза как на уровне растения, так и фитоценоза, позволяют видеть основные направления оптимизации фотосинтеза и увеличения продуктивности растений. Наиболее полно вопросы фотосинтетической деятельности растений в посевах, связанной с образованием хозяйственного урожая (используемого человеком), его доли в биологическом урожае (т. е. суммарной массе всех органов растения), освещены в работах А. А. Ничипоровича. Наивысшие урожаи могут быть обеспечены созданием следующих оптимальных условий: 1) увеличением листовой поверхности в посевах; 2) удлинением времени активной работы фотосинтетического аппарата в течение каждых суток и вегетационного периода (поддержка агротехникой и минеральными удобрениями); 3) высокой интенсивностью и продуктивностью фотосинтеза, максимальными суточными приростами сухого вещества; 4) максимальным притоком продуктов фотосинтеза из всех фотосинтезирующих органов в хозяйственно важные органы и высоким уровнем использования ассимилятов в ходе биосинтетических процессов.
|
|
|
Для получения высоких урожаев сельскохозяйственных культур необходима селекционно-генетическая работа, направленная на повышение интенсивности фотосинтеза, скорости оттока ассимилятов, на увеличение чистой продуктивности фотосинтеза.
К. А. Тимирязев, который первым начал изучать космическую роль зеленых растений, в публичной лекции, прочитанной в 1875 г., следующим образом представил эту проблему слушателям: «...луч солнца... упал на зеленую былинку пшеничного ростка... Он... затратился на внутреннюю работу... превратясь в растворимый сахар... отложился, наконец, в зерне в виде крахмала или в виде клейковины. В той или другой форме он вошел в состав хлеба, который послужил нам пищей. Он преобразился в наши мускулы, внаши нервы. Этот луч солнца согревает нас. Он приводит нас в движение. Быть может, в эту минуту он играет в нашем мозгу».
Действительно, фотосинтез - единственный процесс на Земле, идущий в грандиозных масштабах и связанный с превращением энергии солнечного света в энергию химических связей. Эта космическая энергия, запасенная зелеными растениями, составляет основу для жизнедеятельности всех других гетеротрофных организмов на Земле от бактерий до человека. Выделяют пять аспектов космической и планетарной роли растений, которые рассмотрены ниже.
1. Накопление органической массы. В процессе фотосинтеза наземные растения образуют 100—172 млрд. т, а растения морей и океанов — 60 — 70 млрд. т биомассы в год (в пересчете на сухое вещество). Общая масса растений на Земле в настоящее время составляет 2402,7 млрд. т, причем 90% этой сухой массы приходится на целлюлозу. На долю наземных растений приходится 2402,5 млрд. т, а на растения гидросферы — всего 0,2 млрд. т (из-за недостатка света). Общая масса животных и микроорганизмов на Земле — 23 млрд. т, что составляет около 1 % от растительной биомассы. Из этого количества 20 млрд. т приходится на обитателей суши, а 3 млрд. т — на животных и микроорганизмы гидросферы.
|
|
|
За время существования жизни на Земле органические остатки растений и животных накапливались и модифицировались. На суше эти органические вещества представлены в виде подстилки, гумуса и торфа, из которых при определенных условиях в толще литосферы формировался уголь. В морях и океанах органические остатки (главным образом животного происхождения) оседали на дно и входили в состав осадочных пород. При опускании в более глубокие области литосферы из этих остатков под действием микроорганизмов, повышенных температур и давления образовывались газ и нефть. Масса органических веществ подстилки, торфа и гумуса оценивается в 194, 220 и 2500 млрд. т соответственно. Нефть и газ составляют 10000-12000 млрд. т. Содержание органических веществ в осадочных породах достигает 20000000 млрд. т (по углероду).
Особенно интенсивное накопление мертвых органических остатков происходило 300 млн. лет назад в палеозойскую эру. Запасы древесины, а в последние 200 лет угля, нефти и газа используются человеком для получения энергии, необходимой в быту, промышленности и сельском хозяйстве.
2. Обеспечение постоянства содержания СО2 в атмосфере. Образование органических веществ гумуса, осадочных пород и горючих ископаемых выводило значительные количества СО2 из круговорота углерода. В атмосфере Земли СО2 становилось все меньше и в настоящее время он составляет только 0,03% (по объему), или (в абсолютных значениях) 711 млрд. т в пересчете на углерод.
В кайнозойской эре содержание диоксида углерода в атмосфере стабилизировалось и испытывало лишь суточные, сезонные и более длительные геохимические колебания. Эта стабилизация достигается сбалансированным связыванием и освобождением СО2, осуществляемых в глобальном масштабе. Связывание СО2 в ходе фотосинтеза и образование карбонатов компенсируется выделением СO2 за счет других процессов. Ежегодное поступление СО2 в атмосферу в пересчете на углерод (в млрд. т) обусловлено: дыханием растений — 10, дыханием и брожением микроорганизмов — 25, дыха- • нием животных и человека — 1,6, производственной деятельностью людей — 5, геохимическими процессами — 0,051. При отсутствии этого поступления весь СО2 атмосферы был бы связан в ходе фотосинтеза за 6 — 7 лет. Мощным резервом диоксида углерода является Мировой океан, в водах которого растворено в 60 раз больше СО2, чем находится в атмосфере. Фотосинтез, с одной стороны, дыхание организмов и карбонатная система океана, с другой, поддерживают относительно постоянный уровень СО2 в атмосфере.
Однако за последние десятилетия из-за все более возрастающего сжигания человеком горючих ископаемых, а также из-за вырубки лесов и разложения гумуса содержание СО2 в атмосфере начало увеличиваться примерно на 0,23% в год. Это обстоятельство может иметь далеко идущие последствия в связи с тем, что концентрация СО2 оказывает влияние на тепловой режим Земли (см. ниже).
3. Парниковый эффект. Поверхность Земли получает теплоту главным образом от Солнца. Часть этой теплоты поступает обратно в космос в виде инфракрасных лучей. Диоксид углерода в атмосфере, а также вода поглощают инфракрасное излучение и таким образом сохраняют значительное количество теплоты на Земле (парниковый эффект). Микроорганизмы и растения в процессе дыхания или брожения поставляют 85 % общего количества СО2, поступающего ежегодно в атмосферу, и вследствие этого оказывают влияние на тепловой режим нашей планеты.
Тенденция к повышению содержания СО2 в атмосфере из-за сжигания огромных количеств нефти, газа и из-за других причин, указанных выше, может способствовать увеличению средней температуры на поверхности Земли, что приведет к ускорению таяния ледников в горах и на полюсах и затоплению прибрежных зон. Возможно, однако, что повышение концентрации СО2 будет способствовать усилению фотосинтеза растений, что устранит избыточное накопление диоксида углерода. Известно, что изменение концентрации СО2 в биосфере выступает как элемент обратной связи.
4. Накопление кислорода в атмосфере. Первоначально в атмосфере Земли О2 присутствовал в следо вых колличествах. В настоящее время он составляет 21 % по объему воздуха. Появление и накопление О2 в атмосфере связано с жизнедеятельностью зеленых растений. Ежегодно в ходе фотосинтеза кислород поступает в атмосферу в количестве 70—120 млрд. т. Этот кислород необходим для дыхания всех гетеротрофов — бактерий, грибов, животных и человека, а также зеленых растений в ночное время.
Особое значение в поддержании высокой концентрации О2 в атмосфере имеют леса. Подсчитано, что 1 га леса весной и летом за час выделяет О2 в количестве, достаточном для дыхания 200 человек.
 5.Озоновый экран. Еще одно важнейшее следствие выделения растениями кислорода — образование озонового экрана в верхних слоях атмосферы на высоте около 25 км. Озон (О3) образуется в результате фотодиссоциации молекул О2 под действием солнечной радиации. Озон задерживает большую часть ультрафиолетовых лучей (240 — 290 нм), губительно действующих на все живое. Возможность частичного разрушения озонового экрана из-за загрязнения атмосферы промышленными и другими отходами — серьезная проблема охраны биосферы.
5.Озоновый экран. Еще одно важнейшее следствие выделения растениями кислорода — образование озонового экрана в верхних слоях атмосферы на высоте около 25 км. Озон (О3) образуется в результате фотодиссоциации молекул О2 под действием солнечной радиации. Озон задерживает большую часть ультрафиолетовых лучей (240 — 290 нм), губительно действующих на все живое. Возможность частичного разрушения озонового экрана из-за загрязнения атмосферы промышленными и другими отходами — серьезная проблема охраны биосферы.
Появление и эволюция живых организмов связаны с изменениями физико-химических условий на поверхности Земли. В свою очередь жизнедеятельность самих организмов оказывала и оказывает сильнейшее влияние на окружающую среду. Таким образом, система организмы — среда (т. е. биосфера) развивалась как единое целое. Последовательность этапов эволюции биосферы и их возраст можно представить в виде следующей гипотетической схемы (1 — условия среды, 2 — тип обмена веществ):
4,5 млрд. лет 1. Состав атмосферы: Н2О, СО2 и в небольших млрд. лет количествах N2, CH4, NH3, H2S и др. О2 практически отсутствует. Высокая температура, ультрафиолетовая радиация и электрические разряды способствуют синтезу органических веществ.
2. Абиотический синтез простых органических соединений и накопление их в первичном океане.
4,0 млрд. лет 1. Снижение температуры, уменьшение облачности, млрд. лет появление следов О2 и озонового экрана из-за диссо циации паров воды под действием ультрафиолетовой радиации.
2. Образование сложных органических молекул: по-липептидов, полисахаридов, нуклеиновых кислот, липидов, металлоорганических соединений с каталитическими и фотохимическими свойствами (в том числе металлопор-фиринов).
Образование предбиологических структур типа коацерватов (А. И. Опарин) или протеиноидных микросфер (С. Фокс). Появление самовоспроизводящихся метаболических циклов (М. Эйген). Объединение всех этих компонентов в единой системе протобионтов.
3,8 млрд. лет 1. Те же тенденции. Увеличение количества света, млрд. лет достигающего поверхности Земли.
2. Появление первичных анаэробных гетеротрофов, способных к брожению и обладающих окислительным пентозофосфатным циклом, которые питаются абиогенно синтетизированными органическими веществами. У некоторых из них свет с участием пигментов способствует окислению органических веществ (фотоорганотрофия); у других появляется способность в условиях гетеротрофного питания переносить электроны на сульфат или нитрат с участием цитохромов (хеморедукция).
3,0 млрд. лет 1. Повышенное содержание СО2, обусловленное жизнедеятельностью анаэробных гетеротрофов. Истощение абиогенно синтезированных органических веществ. Свет (400-800 нм). Следы О2.
2. Появление автотрофов, осуществляющих фоторедукцию (см. 3.3.1). В качестве легкоокисляемых веществ используются H2S, СН4, Н2 и др.
2,0- 2,5 млрд. лет 1. Те же тенденции. Истощение легко окисляющихся веществ, необходимых для фоторедукции.
2. Появление автотрофов-фотосинтетиков с системой нециклического фотофосфорилирования и механизмом фоторазложения воды (цианобактерии и зеленые водоросли).
1,5 млрд. лет 1. Повышение содержания О2 и уменьшение концентрации СО2 в атмосфере и гидросфере в результате деятельности фотосинтезирующих организмов.
2. Появление вторичных гетеротрофов (с аэробным типом дыхания) и аэробных хемосинтетиков.

Клеточный механизм фотосинтеза в ходе эволюции сформировался у одноклеточных организмов (у бактерий), причем цитохромы начали принимать участие в транспорте электронов, по-видимому, уже у первичных гетеротрофов. Как следует из приведенной схемы, сначала возник механизм циклического фотофосфорилирования (ФС I), а затем у цианобактерии — молекулярный комплекс нециклического фотофосфорилирования (ФС I + ФС II). Пентозофосфатный цикл окисления глюкозы также существовал у первичных гетеротрофов. Его обращение с использованием энергии света стало основным способом восстановления СО2 у растений (цикл Кальвина).
Механизм фотосинтеза у растений сосредоточен в хлоропластах. Большой интерес представляет симбиотическая гипотеза происхождения хлоропластов, выдвинутая впервые А. С. Фаминцыным (1886, 1907) и поддержанная К. С. Мережковским (1905—1909). Согласно этой гипотезе, хлоропласты когда-то были самостоятельными одноклеточными фотосинтезирующими организмами, которые жили в более крупной гетеротрофной клетке как симбионты. В процессе эволюции эти симбиотические отношения дали начало новой, более сложной клетке со специализированными и взаимодействующими органоидами. Фаминцын рассматривал процесс симбиогенеза как важнейший эволюционный путь усложнения клеток. Современные данные во многом подтверждают эту точку зрения. Хлоропласты имеют кольцевую ДНК и рибосомы прокариотического типа. Синтез белков в хлоропластах подавляется хлорамфениколом, как и у бактерий, а не цикло гексимидом, который ингибирует процесс трансляции в цитоплазме эукариотических клеток. Хлоропласты способны к размножению путем простого деления.
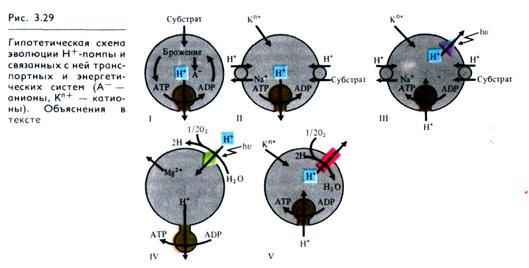
Решающее значение для совершенствования энергетических механизмов клеток имело появление в ходе эволюции способности к активному трансмембранному переносу ионов Н+, АТРазная Н+- помпа (рис. 3.29,1) должна была функционировать уже у самых примитивных клеток — протобионтов — для удаления избытка ионов Н+, которые накапливались в них при брожении (анаэробном окислении глюкозы). В результате выкачивания ионов Н+ во внутриклеточной среде не только поддерживался оптимальный для синтетических процессов уровень рН, но и возникал электрохимический мембранный потенциал, который стал энергетической основой мембранного транспорта и осморегуляции (рис. 3.29, II).
Появление электрохимического мембранного потенциала ионов Н +, возможно, стало поворотным моментом в переходе протобионтов из неживого в живое состояние в соответствии с теорией советского биолога Э. С. Бауэра (1935), согласно которой живое состояние базируется на принципе устойчивого неравновесия.
При переходе бактериальных клеток на фототрофный способ питания роль Н+-помпы стала выполнять в клеточной мембране редокс-цепь. Примером такой светозависимой Н+-помпы является система бактериородопсина (производного каротина) у современных галофильных бактерий (рис. 3.29, III). Мембранный протонный градиент, возникший на мембране, способствовал обращению транспорта ионов Н+ через АТРазу и появлению фотофосфорилирования. Фотохимическая активность бактериородопсина не сопровождается диссоциацией воды и выделением О2.
Основой светозависимой Н+- помпы в растительном мире 'стала пигментная система, в состав которой входят хлорофиллы. В результате образования тилакоидов путем инвагинации поверхностной мембраны у предшественников хлоро-пластов (симбионтов) Н+-помпа переносит ионы Н+ во внутреннее пространство тилакоидов (рис. 3.29, IV). Пассивный выход ионов Н+ через протонный канал АТРазы по концентрационному градиенту сопровождается синтезом АТР (см. рис. 4.8).
В клеточной мембране аэробных гетеротрофных бактерий и во внутренней мембране митохондрий1 эукариотических клеток в качестве Н+-помпы функционирует дыхательная электронтранспортная цепь, выкачивающая ионы Н+ наружу (рис. 3.29, V). В результате обратного пассивного транспорта протонов синтезируется АТР (окислительное фосфорилирование). Таким образом, приспособительная эволюция энергетических систем живых организмов, а вместе с тем и газообмена клеток с окружающей средой связана с преобразованием механизмов Н+- помпы.
В ходе дальнейшей эволюции растений (появление много-клеточности, выход на сушу) внутриклеточная организация процессов фотосинтеза изменялась незначительно. Примером таких изменений может служить появление С4-пути фотосинтеза и САМ-метаболизма. Прогрессивное развитие функции фото-трофного питания у многоклеточных растений в основном происходило за счет анатомо-морфологических приспособлений. Главное из этих приспособлений — появление листа как специализированного органа фотосинтеза и совершенствование его анатомической структуры.
В ходе световой фазы фотосинтеза в мембранах'тилакоидов хло-ропластов энергия света используется для окисления Н2О (с выделением О2), восстановления NADP+ и образования трансмембранного электрохимического потенциала ионов Н+, который трансформируется в энергию высокоэнергетической фосфатной связи АТР (фото-фосфорилирование). Молекулы хлорофилла, поглощающие красный и синий свет, выполняют функцию фотосенсибилизаторов. Кароти-ноиды защищают хлорофилл от разрушения, а также, как и фико-билины у водорослей, служат дополнительными пигментами. В основе световой фазы фотосинтеза лежит механизм Н +- помпы.
В ходе темновой фазы фотосинтеза энергия АТР и NADPH расходуется на восстановительное карбоксилирование (ассимиляцию СО2) с образованием 3-фосфоглицеринового альдегида (С3-путь фотосинтеза) или органических кислот (Сунуть) в качестве первичных продуктов. Энергия света в хлоропластах может использоваться также на восстановление NO3 и SО2-4. При недостатке СО2 и избытке О2 включается фотодыхание с участием пероксисом.
Строение листа, его движения, работа устьичного аппарата, отток ассимилятов служат для оптимизации фотосинтетической деятельности растений. Фотосинтез — важнейший процесс биосферы. Возникнув на первых этапах эволюции жизни, он выполняет космическую функцию, производя за счет солнечной радиации огромное количество растительной биомассы и поставляя кислород в атмосферу.
Глава 4

 ДЫХАНИЕ РАСТЕНИЙ
ДЫХАНИЕ РАСТЕНИЙ
 Образующиеся в ходе фотосинтеза сахара и другие органические соединения используются клетками растительного организма в качестве питательных веществ. Клетки незеленых частей и все клетки растения в темноте питаются веществами углеводной природы гетеротрофно и в этом принципиально не отличаются от животных клеток. Важнейшим этапом питания органическими веществами на клеточном уровне является процесс дыхания.
Образующиеся в ходе фотосинтеза сахара и другие органические соединения используются клетками растительного организма в качестве питательных веществ. Клетки незеленых частей и все клетки растения в темноте питаются веществами углеводной природы гетеротрофно и в этом принципиально не отличаются от животных клеток. Важнейшим этапом питания органическими веществами на клеточном уровне является процесс дыхания.
Клеточное дыхание — это окислительный, с участием кислорода распад органических питательных веществ, сопровождающийся образованием химически активных метаболитов и освобождением энергии, которые используются клетками для процессов жизнедеятельности.
Научные основы учения о роли кислорода в дыхании были заложены трудами А. Л. Лавуазье. В 1774 г. кислород независимо открыли Пристли и Шееле, а Лавуазье дал название этому элементу. Изучая одновременно процесс дыхания животных и горение, Лавуазье в 1773-1783 гг. пришел к выводу, что при дыхании, как и при горении, поглощается О2 и образуется СО2, причем в том и другом случаях выделяется теплота. На основании своих опытов он заключил, что процесс горения состоит в присоединении кислорода к субстрату и что дыхание есть медленно текущее горение питательных веществ в живом организме.
Я. Ингенхауз в 1778-1780 гг. показал, что зеленые растения в темноте, а незеленые части растений и в темноте, и на свету поглощают кислород и выделяют СО2 так же, как животные. Основателем учения о дыхании растений считают Н. Т. Соссюра. В 1797-1804 гг., впервые широко использовав количественный анализ, он установил, что в темноте растения поглощают столько же кислорода, сколько выделяется СО2, т.е. соотношение СО2/О2, как правило, равно 1. При этом одновременно с СО2 образуется и вода. Мнение Соссюра о том, что описанный им газообмен у растений является процессом дыхания и что этот процесс обеспечивает растительный организм энергией, долгое время не признавалось. Утверждалось, что в ночное время растения выделяют тот СО2, который не был использован при фотосинтезе, и что этот СО2 не имеет отношения к дыханию.
 Однако постепенно накапливалось все больше данных о том, что дыхание животных и растений протекает однотипно, несмотря на отсутствие у растений специальных дыхательных органов, причем основным субстратом дыхания служат сахара. И. П. Бородин (1876) в серии точных опытов установил, что интенсивность дыхания листоносных побегов в темноте в первую очередь зависит от количества углеводов, накопленных ими на свету.
Однако постепенно накапливалось все больше данных о том, что дыхание животных и растений протекает однотипно, несмотря на отсутствие у растений специальных дыхательных органов, причем основным субстратом дыхания служат сахара. И. П. Бородин (1876) в серии точных опытов установил, что интенсивность дыхания листоносных побегов в темноте в первую очередь зависит от количества углеводов, накопленных ими на свету.
Во второй половине XIX в. в результате изучения дыхания у растительных и животных объектов общее уравнение этого процесса приняло следующий вид:
С6Н12О6 + 6О2——> 6СО2 + 6Н2О + энергия (2875 кДж/моль)
Если, по Лавуазье, дыхание имеет сходство с процессом горения, то каким же образом органические вещества могут «гореть» при обычной температуре тела организма, да еще в водной среде, (ведь на 70 — 90% масса живых организмов состоит из воды)? Возникло предположение о том, что в живых клетках существуют механизмы, активирующие кислород. Швейцарский химик X. Ф. Шейнбайн, открывший озон, изучал причины быстрого потемнения пораненной поверхности растительных тканей, таких, как ткани яблок, картофеля, плодовых тел грибов. В 1845 г. он выступил со своей теорией окислительных процессов, согласно которой в живых клетках имеются соединения, способные легко окисляться в присутствии О2 и таким образом активировать молекулярный кислород. Если ткань прокипятить, то потемнения не происходит. Следовательно, потемнение тканей — каталитический окислительный процесс. Шейнбайн ошибочно полагал, что активация кислорода — это образование озона.
Исследования, начатые Шейнбайном, продолжил А. Н. Бах, который в 1897 г. разработал перекисную теорию биологического окисления, приложив ее к процессам дыхания. Несколько позже, в том же 1897 г., аналогичные взгляды высказал немецкий исследователь К. Энглер.
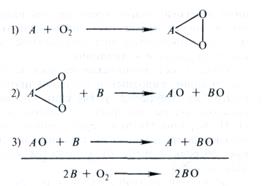
Суть перекисной теории биологического окисления Баха заключается в следующем. Молекулярный кислород имеет двойную связь и для того чтобы его активировать, необходимо эту двойную связь расщепить. Легко окисляющееся соединение А взаимодействует с кислородом и, разрывая двойную связь, образует пероксид AО2. Таким образом, по мысли Баха, активация кислорода есть образование пероксида. В свою очередь пероксидное соединение, взаимодействуя с соединением В, окисляет его; затем эта реакция повторяется со вторым атомом кислорода и второй молекулой соединения В. Получается полностью восстановленное исходное соединение — акцептор кислорода А и полностью окисленное вещество В:
Во второй и третьей реакциях, по Баху, участвует пероксидаза. Соединение А, которое активирует кислород, Бах назвал «оксигеназой», рассматривая его вначале как фермент. В дальнейшем он пришел к заключению, что это те соединения, которые темнеют на воздухе при поранении тканей, что именно такого рода легко окисляющиеся вещества способны присоединять кислород и образовывать пероксиды.
Много позднее, в 1955 г., две группы исследователей О. Хаяиши с сотр. в Японии и Г. С. Мэзон с сотр. в США, используя современные методы, проанализировали возможность включения кислорода в органические соединения. Применив тяжелый изотоп кислорода, Хаяиши изучил процесс окисления пирокатехина до пирокатеховой кислоты под действием пирокатехазы:
 2015-05-26
2015-05-26 1099
1099








