α-кетоглутарат, подобно пирувату, подвергается реакции окислительного декарбоксилирования. α- кетоглутаратдегидро-геназный мультиэнзимный комплекс сходен с рассмотренным выше пируватдегидрогеназным комплексом. В ходе реакции окислительного декарбоксилирования α- кетоглутарата выделяется СО2, образуются NADH и сукцинил-СоА.
Подобно ацетил - СоА, сукцинил- СоА является высокоэнергетическим тиоэфиром. Однако если в случае с ацетил - СоА энергия тиоэфирной связи расходуется на синтез лимонной кислоты, энергия сукцинил-СоА может трансформироваться в образование фосфатной связи АТР. При участии сукцинил – СоА - синтетазы из сукцинил- СоА, ADP и Н3РО4 образуются янтарная кислота (сукцинат), АТР, регенерирует молекула СоА. АТР образуется в результате субстратного фосфори- лирования. На следующем этапе янтарная кислота окисляется до фумаровой. Реакция катализируется сукцинатдегидрогеназой, коферментом которой является FAD. Фумаровая кислота под действием фумаразы или фумаратгидратазы, присоединяя Н2О, превращается в яблочную кислоту (малат). И, наконец, на последнем этапе цикла яблочная кислота с помощью NAD-зависимой малатдегидрогеназы окисляется в щавелевоуксус-ную. ЩУК, которая самопроизвольно переходит в енольную форму, реагирует с очередной молекулой ацетил-СоА и цикл повторяется снова.
|
|
|
Следует отметить, что большинство реакций цикла обратимы, однако ход цикла в целом практически необратим. Причина этого в том, что в цикле есть две сильно экзерго нические реакции - цитратсинтазная и сукцинил-СоА-синте-тазная.
На протяжении одного оборота цикла при окислении пирувата происходит выделение трех молекул СО2, включение трех молекул Н2О и удаление пяти пар атомов водорода. Роль Н2О в цикле Кребса подтверждает правильность уравнения Палладина, который постулировал, что дыхание идет с участием Н2О, кислород которой включается в окисляемый субстрат, а водород с помощью «дыхательных пигментов» (по современным представлениям — коферментов дегидрогеназ) переносится на кислород (см. 4.1.3).
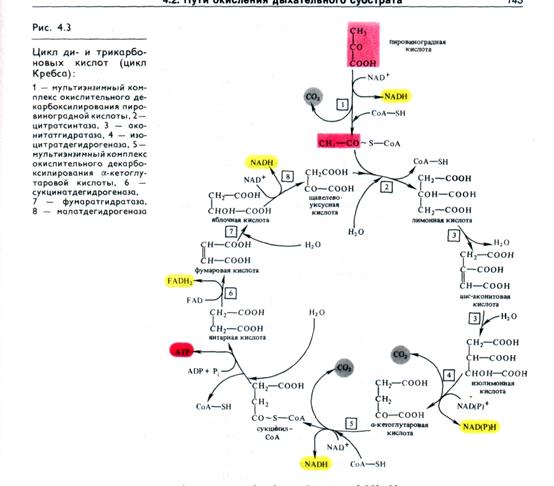
Выше отмечалось, что цикл Кребса был открыт на животных объектах. Существование его у растений впервые доказал английский исследователь А. Чибнелл (1939). В растительных тканях содержатся все кислоты, участвующие в цикле; обнаружены все ферменты, катализирующие превращение этих кислот; показано, что малонат — ингибитор сункцинатдегидрогеназы — тормозит окисление пирувата и резко снижает поглощение О2 в процессах дыхания у растений. Большинство ферментов цикла Кребса локализовано в матриксе митохондрий, аконитаза и сукцинатдегидрогеназа — во внутренней мембране митохондрии.
|
|
|
Энергетический выход цикла Кребса, его связь с азотным обменом. Цикл Кребса играет чрезвычайно важную роль в обмене веществ растительного организма. Он служит конечным этапом окисления не только углеводов, но также белков, жиров и других соединений. В ходе реакций цикла освобождается основное количество энергии, содержащейся в окисляемом субстрате, причем большая часть этой энергии не теряется для организма, а утилизируется при образовании высоко- энергетических конечных фосфатных связей АТР.
Каков же энергетический выход цикла Кребса? В ходе окисления пирувата имеют место 5 дегидрирований, при этом получаются 3NADH, NADPH (в случае изоцитратдегидроге-назы) и FADH2. Окисление каждой молекулы NADH (NADPH) при участии компонентов электронтранспортной цепи митохондрий дает по 3 молекулы АТР, а окисление FADH2 — 2ATP. Таким образом при полном окислении пирувата образуются 14 молекул АТР. Кроме того, 1 молекула АТР синтезируется в цикле Кребса в ходе субстратного фосфорилирования. Следовательно, при окислении одной молекулы пирувата может образоваться 15 молекул АТР. А поскольку в процессе гликолиза из молекулы глюкозы возникают две молекулы пирувата, их окисление даст 30 молекул АТР.
 Итак, при окислении глюкозы в процессе дыхания при функционировании гликолиза и цикла Кребса в общей сложности образуются 38 молекул АТР (8 АТР связаны с гликолизом). Если принять, что энергия третьей сложноэфирной фосфатной связи АТР равняется 41,87 кДж/моль (10 ккал/моль), то энергетический выход гликолитического пути аэробного дыхания составляет 1591 кДж/моль (380 ккал/моль), причем основное количество этой энергии — 1256 кДжТмоль
Итак, при окислении глюкозы в процессе дыхания при функционировании гликолиза и цикла Кребса в общей сложности образуются 38 молекул АТР (8 АТР связаны с гликолизом). Если принять, что энергия третьей сложноэфирной фосфатной связи АТР равняется 41,87 кДж/моль (10 ккал/моль), то энергетический выход гликолитического пути аэробного дыхания составляет 1591 кДж/моль (380 ккал/моль), причем основное количество этой энергии — 1256 кДжТмоль
(300 ккал/моль) — поставляют реакции цикла Кребса. Если учесть, что при полном окислении глюкозы изменение свободной энергии равно 2872 кДж/моль (или 686 ккал/моль), то эффективность использования энергии через гликолиз и ЦТК
оказывается весьма высокой 380/686*100= 55,4%.
Значение цикла Кребса не исчерпывается его вкладом в энергетический обмен клетки. Не менее важную роль играет то обстоятельство, что многие промежуточные продукты цикла используются при синтезе различных соединений. Прежде всего следует отметить участие ряда органических кислот в азотном обмене, синтезе и распаде белковых веществ. Из кетокислот в ходе реакций переаминирования и восстановительного аминирования образуются аминокислоты. Из пиро-виноградной кислоты возникает аланин, из щавелевоуксусной и а-кетоглутаровой — соответственно аспарагиновая и глутами-новая кислоты. Аспартат может образовываться также в лиазной реакции, при аминировании фумаровой кислоты с участием фермента аспартазы. Для синтеза липидов, полиизопренов, углеводов и ряда других соединений используется ацетил- СоА.
Даже это краткое перечисление позволяет заключить, что цикл Кребса занимает центральное положение в метаболизме клетки. Особенно важно, что через реакции цикла Кребса устанавливается тесная связь между обменом трех важнейших групп соединений — белков, жиров и углеводов (см. рис. 4.10).
Т'лиоксилатный цикл можно рассматривать как модификацию цикла Кребса. Этот цикл в 1957 г. был впервые описан у бактерий и плесневых грибов Г. Л. Корнбергом и Г. А. Креб-сом. Затем оказалось, что он активно функционирует в прорастающих семенах масличных растений и в других растительных объектах, где запасные жиры превращаются в сахара (глюконеогенез). Глиоксилатный цикл локализован не в митохондриях, как цикл Кребса, а в специализированных микротелах — глиоксисомах (см. 1.1.2). В клетках животных этот цикл отсутствует.
В глиоксилатном цикле из ЩУК и ацетил- СоА синтезируется лимонная кислота, образуются цucаконитовая и изоли-монная (изоцитрат), как и в цикле Кребса (рис. 4.4). Затем изолимонная кислота под действием изоцитрат-лиазы распадается на глиоксиловую и янтарную кислоты. Глиоксилат с участием малатсинтазы взаимодействует со второй молекулой ацетил-СоА, в результате чего синтезируется яблочная кислота, которая окисляется до ЩУК.
|
|
|
Таким образом, в отличие от цикла Кребса в глиоксилатном цикле в каждом обороте участвует не одна, а две молекулы ацетил- СоА и этот активированный ацетил используется не для окисления, а для синтеза янтарной кислоты. Янтарная кислота выходит из глиоксисом, превращается в ЩУК и участвует, как показано на рис. 4.1 и 4.11, в глюконеогенезе (обращенном гликолизе) и других процессах биосинтеза.
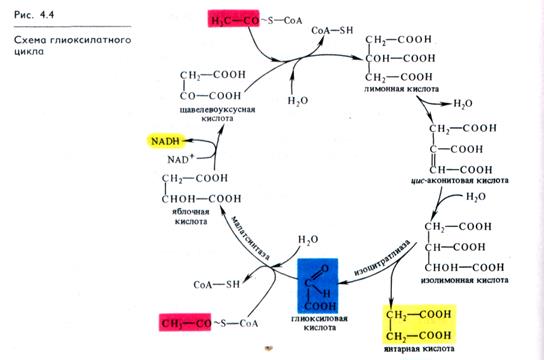
Глиоксилатный цикл позволяет утилизировать запасные жиры, при распаде которых образуются молекулы ацетил- СоА. Кроме
| 4.2.5 Пентозофосфатный путь окисления глюкозы |
того, на каждые две молекулы ацетил-СоА в глиоксилатном цикле восстанавливается одна молекула NADH, энергия которой может быть использована на синтез АТР в митохондриях или на другие процессы.
В клетках растений наряду с гликолизом и циклом Кребса, являющимся главным поставщиком свободной энергии в процессах дыхания, существует и другой важнейший способ катаболизма гексоз — пентозофосфатный путь (ПФП), в котором участвуют пятиуглеродные сахара (пентозы). Этот путь дыхания известен также как гексозомонофосфатный цикл, пен-тозный шунт или апотомическое окисление. Окисление глюкозы (глюкозо-6-фосфата) по этому пути связано с отщеплением первого (альдегидного) атома углерода в виде СО2 (отсюда и название — апотомический путь).
Пентозофосфатный путь дыхания открыт в 1935—1938 гг. в результате исследований О. Варбурга, Ф. Диккенса, В. А. Энгельгардта и позднее Ф. Липмана. Установлено, что все реакции ПФП протекают в растворимой части цитоплазмы клеток, а также в пропластидах и хлоропластах. ПФП дыхания особенно активен в тех клетках и тканях растений, в которых интенсивно идут синтетические процессы, такие, как синтез липидных компонентов мембран, нуклеиновых кислот, клеточных стенок, фенольных соединений.
|
|
|
В ПФП АТР используется только для образования исходного продукта: для фосфорилирования глюкозы до глюкозофосфата; ни в одной реакции этого цикла АТР не образу ется. ПФП, как и цикл Кребса, — циклический процесс, поскольку окисление глюкозы сопровождается регенерацией исходного субстрата ПФП — глюкозо-6-фосфата.
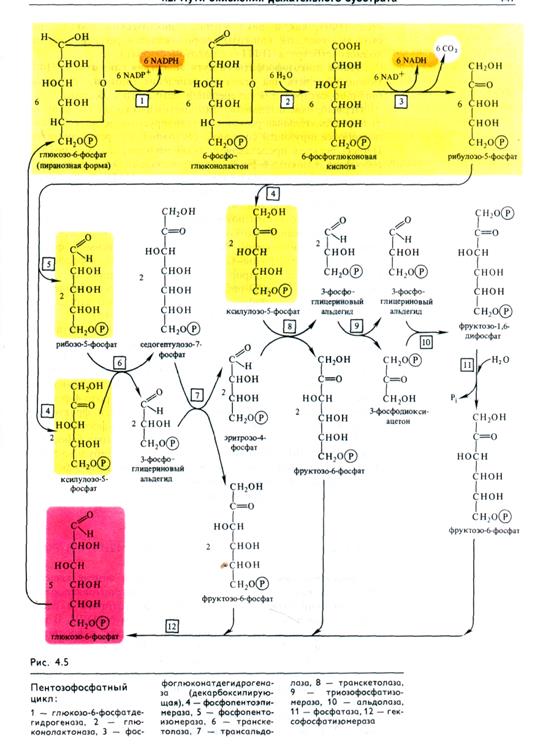
Этапы пентозофосфатного пути окисления глюкозы. В ПФП можно выделить два этапа: 1) окисление глюкозы, 2) рекомбинацию Сахаров для регенерации исходного субстрата.
Первый, окислительный, этап апотомического пути включает последовательные реакции, катализируемые дегидрогеназно-декарбоксилирующей системой, состоящей из трех ферментов. Первая реакция представляет собой дегидрирование глюкозо-6-фосфата глюкозо-6-фосфатдегидрогеназой. Этот фермент в качестве акцептора электронов использует NADP+. Он дегид-рирует 1-й атом углерода глюкозо-6-фосфата с образованием лактона 6-фосфоглюконовой кислоты. Лактон самопроизвольно или под действием глюконолактоназы гидролизуется, образуя 6-фосфоглюконовую кислоту. В следующей окислительной реакции, катализируемой NADP- и Мп2+-зависимой фосфо-глюконатдегидрогеназой (декарбоксилирующей), 6-фосфоглю-коновая кислота дегидрируется и декарбоксилируется. В результате образуются О-рибулозо-5-фосфат и восстановленный NADPH. Таким образом, при окислении каждого атома углерода образуются две молекулы NADPH (рис. 4.5).
Второй этап связан с регенерацией исходного метаболита — глюкозо-6-фосфата. Из рибулозо-5-фосфата под действием эпимеразы образуется ксилулозо-5-фосфат, а под действием изомеразы — рибозо-5-фосфат. Рекомбинации Сахаров с участием транскетолазы и трансальдолазы приводят к появлению 3-ФГА и седогептулозо-7-фосфата, затем эритрозо-4-фосфата и фруктозо-6-фосфата; в результате образуются фруктозо-6-фосфаты, которые изомеризуются в глюкозо-6-фосфат.
Как видно из рис. 4.5, 6 молекул глюкозо-6-фосфата, участвуя в ПФП дыхания, дают 6 молекул рибулозо-5-фос-фата и 6СО2, после чего из 6 молекул рибулозо-5-фосфата регенерируют 5 молекул глюкозо-6-фосфата. Для каждого оборота цикла суммарное уравнение ПФП имеет следующий вид:
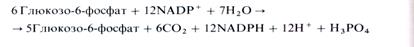
Энергетический выход ПФП и его роль в обмене веществ.
Универсальным донором водорода для электронтранспортной цепи дыхания служит NADH, содержание которого в растительных тканях всегда значительно выше, чем NADPH. В нормальных условиях NADP+ находится в клетках в восстановленной форме NADPH, тогда как NAD+ — в окисленной. Доказано, что NADPH окисляется медленнее, чем NADH. Если при окислении субстрата образуется NADPH, как, например, при апотомическом окислении глюкозо-6-фосфата, то атомы водорода перед поступлением в электронтранспортную цепь должны" быть переданы на. NAD+ (трансгидрогеназная реакция). Если бы все 12 пар протонов от NADPH, которые образуются при полном окислении молекулы глюкозо-6-фос-фата по ПФП, были бы переданы через ЭТЦ на О2, то получилось бы 3 АТР х 12 = 36 АТР, что составляет 41,868 кДж х36=1507 кДж/моль. Практически это не уступает энергетическому выходу дихотомического пути дыхания (гликолиз и цикл Кребса), в котором образуется 1591 кДж/моль (38 АТР). Однако основное назначение ПФП состоит в участии не столько в энергетическом, сколько в пластическом обмене клеток. Это участие в пластическом обмене включает несколько аспектов:
1. NADPH используется главным образом в различных синтетических реакциях. ПФП служит основным внемитохонд-риальным и внехлоропластным источником NADPH, который необходим для синтеза жирных кислот, жиров, изопреноидов, для восстановительного карбоксилирования пирувата, восстановления нитрата и сульфата и т. д. NADPH играет значительную роль и в поддержании восстановленности SH-соединений в клетке, поскольку является первичным восстановителем глутатиона.
2. В ходе пентозофосфатного цикла синтезируются пентозы, входящие в состав нуклеиновых кислот и различных нуклео-тидов (пиридиновых, флавиновых, адениловых и др.). Для животных и других гетеротрофных организмов ПФП — единственный способ образования пентоз (рибоз и дезоксирибоз) в клетке. Рибозы необходимы для синтеза АТР, GTP, UTP и других нуклеотидов. Коферменты NAD+, NADP+, FAD, коэнзим А — тоже нуклеотиды и в их состав входит рибоза.
3. ПФП имеет большое значение как источник образования углеводов с различным числом углеродных атомов в цепи (от С3 до С7). Эритрозо-4-фосфат, возникающий в ПФП, необходим для синтеза шикимовой кислоты — предшественника многих ароматических соединений, таких, как ароматические аминокислоты, витамины, дубильные и ростовые вещества, лигнин клеточных стенок и др.
4. Компоненты ПФП (рибулозо-1,5-дифосфат, NADPH) принимают участие в темновой фиксации СО2. По существу, ПФП представляет собой обращенный фотосинтетический (восстановительный) цикл Кальвина. Только две из 15 реакций цикла Кальвина специфичны для фотосинтеза, остальные участвуют в окислительном ПФП дыхания и гликолизе.
5. В хлоропластах окислительный ПФП функционирует в темноте, предотвращая резкое изменение концентрации NADPH в отсутствие света. Кроме того, триозофосфаты этого цикла в хлоропластах превращаются в 3-ФГК, что важно для поддержания в них уровня АТР в темноте.
 Окисление глюкозы по ПФП осуществляется в результате 12 реакций, тогда как в дихотомический (гликолитический) путь через ПВК и далее через цикл ди- и трикарбоновых кислот включаются более 30 различных реакций.
Окисление глюкозы по ПФП осуществляется в результате 12 реакций, тогда как в дихотомический (гликолитический) путь через ПВК и далее через цикл ди- и трикарбоновых кислот включаются более 30 различных реакций.
Не следует, однако, думать, что окисление глюкозо-6-фос-фата по схеме, представленной на рис. 4.5, идет во всех клетках до конца. Очень часто на одном из этапов ПФП переходит в гликолитический. Таким этапом может быть, в частности, транскетолазная реакция (рис. 4.5, реакция 8), в результате которой ксилулозо-5-фосфат и эритрозо-4-фосфат превращаются во фруктозо-6-фосфат и 3-ФГА — субстраты, общие для гликолиза и ПФП.
Гликолитический путь, в основе которого лежит двукратное фосфорилирование гексозы, и ПФП с одним фосфорилирова-нием глюкозы — не единственные пути окисления молекулы сахара. Некоторые организмы способны окислять и нефосфо-рилированную глюкозу. Этот путь прямого окисления Сахаров обнаружен у некоторых бактерий, грибов и животных, а также у фотосинтезирующих морских водорослей. Достоверных сведений о существовании этой системы окисления свободной глюкозы у высших растений пока нет.
Еще в 1904 г. Н. А. Максимов показал, что из мицелия плесневого гриба Asperyillus niger может быть выделен ферментный препарат, способный окислять глюкозу в глюконо-вую кислоту. Реакция сопровождается выделением пероксида водорода, который затем разлагается каталазой или перокси-дазой. Окисление глюкозы до глюконовой кислоты осуществляется специфической флавинзависимой оксидазой — глюкооксида-зой, содержащей в своем составе две молекулы FAD и 15% (от ее массы) углеводов. Фермент отнимает два атома водорода от СНОП 1-го углерода глюкозы, находящейся в пира-нозной форме, и переносит его на молекулярный кислород. Перед окислением происходит превращение (мутаротация) ос-глюкозы в (3-форму, что катализируется ферментом мутаротазой. Мутаротаза всегда сопутствует глюкооксидазе в препарате из плесневых грибов. Первичный продукт окисления — лактон глюконовой кислоты, который, гидратируясь неферментативным путем, превращается в глюконовую кислоту:
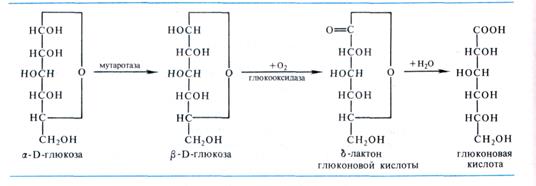
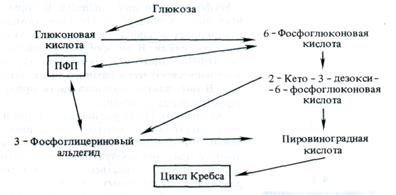
Образовавшаяся глюконовая кислота может вовлекаться в дальнейший метаболизм после ее фосфорилирования с образованием 2-кето-3-дезокси-6-фосфоглюконовой кислоты. Последняя распадается на две триозы — пировиноградную кислоту и 3-фосфоглицериновый альдегид, которые через пировиноградную кислоту могут окисляться в цикле Кребса. Такой путь до пирувата был открыт Н. Энтнером и М. Дудоровым
(1952) для бактерий рода Pseudomonas. Путь Энтнера —Дудо-рова сближает два пути дыхания — ПФП и ЦТК — через пи-руват. Взаимодействие этих трех путей дыхания можно представить в виде схемы, в которой через пируват устанавливается связь с циклом Кребса, а через глюконовую кислоту и 3-фосфоглицериновый альдегид — с ПФП, минуя сахара с четырьмя, пятью и семью атомами углерода:

Если в процессе дыхания прямому окислению подвергаются и другие сахара, кроме глюкозы, то образуется целое семейство кислот, названных кислотами прямого (первичного) окисления Сахаров. Глюкозооксидаза способна окислять только D-глюко-зу. В этом отношении она отличается от D-гексозооксидазы, способной наряду с D-глюкозой окислять и другие гексозы (мальтозу, лактозу, целлобиозу) с образованием соответствующих альдоновых кислот.
В тканях высших растений С. В. Солдатенков с сотрудниками обнаружил ряд кислот первичного окисления Сахаров, имеющих в своем составе 4, 5, 6 и 7 углеродов (тетроновая, гептоновая и др.). Введенные в растительные клетки, эти кислоты используются в процессе дыхания. Из глюкуроновой и галактуроновой кислот в клетках может образоваться аскорбиновая кислота (витамин С).
 Дыхательные циклы — гликолиз и цикл ди- и трикарбоновых кислот, ПФП и прямое окисление Сахаров — система взаимосвязанных процессов.
Дыхательные циклы — гликолиз и цикл ди- и трикарбоновых кислот, ПФП и прямое окисление Сахаров — система взаимосвязанных процессов.
Ниже представлена схема этих взаимосвязей:
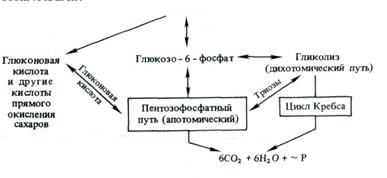
О взаимоотношениях гликолиза и ПФП с прямым окислением Сахаров говорилось выше. Эта связь осуществляется через глюконовую кислоту и фосфотриозы.
В клетке гликолиз и ПФП пространственно не отделены друг от друга. Эти процессы протекают в растворимой части цитоплазмы, в пропластидах и в хлоропластах. Они имеют общие субстраты — глюкозо-6-фосфат, фруктозо-6-фосфат и 3-фосфоглицериновый альдегид. В норме доля пентозофосфат-ного цикла в общем дыхательном обмене составляет 10 — 40% и варьирует в зависимости от типа ткани и ее функционального состояния. В анаэробных условиях гликолиз доминирует над ПФП. Однако в хлоропластах активность окислительного апотомического пути намного выше по сравнению с гликолизом. В цитоплазме большая часть продуктов ПФП метаболи-зируется через гликолиз.
 Активность ПФП увеличивается при неблагоприятных условиях: засухе, калийном голодании, инфекции, затенении, засолении, при старении. Скорость окисления NADPH или подавляющее действие продуктов одного пути дыхания на реакции другого играют существенную роль в регуляции соотношения различных дыхательных циклов.
Активность ПФП увеличивается при неблагоприятных условиях: засухе, калийном голодании, инфекции, затенении, засолении, при старении. Скорость окисления NADPH или подавляющее действие продуктов одного пути дыхания на реакции другого играют существенную роль в регуляции соотношения различных дыхательных циклов.
Цикл Кребса, глиоксилатный и пентозофосфатный пути функционируют только в условиях достаточного количества кислорода. В то же время О2 непосредственно не участвует в реакциях этих циклов. Точно так же в перечисленных циклах не синтезируется АТР (за исключением АТР, образующегося в цикле Кребса в результате субстратного фосфорилирования на уровне сукцинил- СоА).
Кислород необходим для заключительного этапа дыхательного процесса, связанного с окислением восстановленных коферментов NADH и FADH2 в дыхательной электронтранс-портной цепи (ЭТЦ) митохондрий. С переносом электронов по ЭТЦ сопряжен и синтез АТР.
Дыхательная ЭТЦ, локализованная во внутренней мембране митохондрий, служит для передачи электронов от восстановленных субстратов на кислород, что сопровождается трансмембранным переносом ионов Н +. Таким образом, ЭТЦ митохондрий (как и тилакоидов) выполняет функцию окислительно-восстановительной Н+- помпы.
Б. Чане и др. (США) в 50-х годах, используя значения окислительно-восстановительных потенциалов известных в то время переносчиков е-, спектрофотометрические данные о временной последовательности их восстановления и результаты ингибиторного анализа, расположили компоненты ЭТЦ митохондрий в следующем порядке:
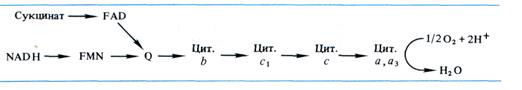
Пара электронов от NADH или сукцината передается по ЭТЦ до кислорода, который, восстанавливаясь и присоединяя два протона, образует воду.
Д. Грин (1961) пришел к выводу, что все переносчики электронов в митохондриальной мембране сгруппированы в четыре комплекса, что было подтверждено дальнейшими исследованиями. Состав и свойства основных компонентов ЭТЦ и их комплексов приведены в табл. 4.1.
Таблица 4.1 Компоненты электронтранспортной цепи митохондрий растений и их стандартные окислительно-восстановительные потенциалы (Е'0)
| Характеристика | ||
| Комплекс I (NADH: CoQ-оксидоредуктаза) Никотинамидадениндинуклеотид восстановленный Флавинмононуклеотид — кофермент дегидрогеназы, окисляющей эндогенный NADH Железосерные белки (центры): N, -2Fe2S; N2, N3 - 4Fe4S | ||
| Комплекс HI (убихинол: цитохром с-оксидо-редуктаза) Гемопротеины, в которых гем связан с белком нековаленгно Цитохром с-552 — гемопротеин; гем кова-лентно связан с белком Железосерный белок Риске (2Fe2S) | ||
| Характеристика | ||
| Цитохром с 550 ~ гемопротеин; гем ковалентно связан с белком; водорастворим | ||
| Комплекс IV (цитохром с: кислород — оксидоредуктаза; цитохромоксидаза) | ||
| Цитохром а — гемопротеин, гем которого нековалентно связан с белком. Спектр поглощения имеет максимумы (77К): 599, 438 и 445 нм Атом меди, функционирующий с цит. а как редокс-компонент комплекса | ||
| Цитохром а3 — гемопротеин; способен взаимодействовать с кислородом. Максимум поглощения при 77К 445 нм Атом меди, функционирующий с цит. аз при образовании комплекса с кислородом | ||
| 1/2О2 + 2Н+ + 2е- ↔ Н2О | ||
Согласно современным данным дыхательная цепь митохондрий включает в себя четыре основных мультиэнзимных комплекса и два небольших по молекулярной массе компонента — убихинон и цитохром с (рис. 4.6, табл. 4.1). Комплекс I осуществляет перенос электронов от NADH к убихинону Q. Его субстратом служат молекулы внутримитохондриального NADH, восстанавливающиеся в цикле Кребса. В состав комплекса входит флавиновая FMN-зависимая NADH: убихинон-оксидоредуктаза, содержащая три железосерных центра (FeSN1-3)- При встраивании в искусственную фосфолипидную мембрану этот комплекс функционирует как протонная помпа.
Комплекс II катализирует окисление сукцината убихи-ноном. Эту функцию осуществляют флавиновая (FAD-зависи-мая) сукцинат: убихинон-оксидоредуктаза, в состав которой также входят три железосерных центра (Fes1-з)-
Комплекс III переносит электроны от восстановленного убихинона к цитохрому с, т. е. функционирует как уби-хинол: цитохром с-оксидоредуктаза. В своем составе он содержит цитохромы b556 и b560, цитохром c1 и железосерный белок Риске. По структуре и функции этот комплекс сходен с цитохромным комплексом b6 — f тилакоидов хлоропластов (см. табл. 3.1). В присутствии убихинона комплекс III осуществляет активный трансмембранный перенос протонов.
В терминальном комплексе IV электроны переносятся от цитохрома с к кислороду, т. е. этот комплекс является цитохром с: кислород-оксидоредуктазой (цитохромоксидазой). В его состав входят четыре редокс-компонента: цитохромы а и а3 и два атома меди. Цитохром а3 Cuв способны взаимодействовать с О2, на который передаются электроны с цитохрома а — СuА. Транспорт электронов через комплекс IV
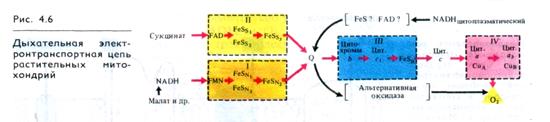
сопряжен с активным транспортом ионов Н+. Взаимодействие цитохрома а3 — Сuв с О2 подавляется цианидом, азидом и СО.
В последние годы в результате изучения пространственного расположения компонентов ЭТЦ во внутренней мембране митохондрий показано, что комплексы I, III и IV пересекают мембрану. Как следует из рис. 4.7, на внутренней стороне мембраны, обращенной к матриксу, два электрона и два протона от NADH поступают на флавинмононуклеотид комплекса I.
Электроны передаются на FeS-центры. Пара электронов от FeS-центров захватывается двумя молекулами окисленного убихинона, которые принимают два иона Н+, образуя семи-хиноны (2QH) и диффундируя к комплексу III. На эти семи-хиноны поступает еще пара электронов от цитохрома b560 комплекса III, что делает возможной реакцию семихинонов с еще двумя протонами из матрикса с образованием 2QH2. Полностью восстановленный убихинон (убихинол) отдает 2е- цитохрому b556 и 2е- FeSR — цитохрому c1. В результате освобождаются четыре иона Н+, выходящие в межмембранное пространство митохондрии. Окисленные молекулы убихинона вновь диффундируют к комплексу I и готовы принимать от него (или от комплекса II) новые электроны и протоны. Таким образом, цитохромы b служат донорами двух электронов для переноса двух дополнительных протонов через липидную фазу мембраны на каждые два электрона, поступающие из комплекса I.
Водорастворимый цитохром с на наружной стороне мембраны, получив 2е- от FeSR — цитохрома с,, передает их на цитохром а — СuА комплекса IV. Цитохром а3 — Сuв, связывая кислород, переносит на него эти электроны, в результате чего с участием двух протонов образуется вода. Как уже отмечалось, цитохромоксидазный комплекс способен также переносить ионы Н+ через митохондриальную мембрану.
Таким образом, из матрикса митохондрии при транспорте каждой пары электронов от NADH к 1/2 О2 в грех участках ЭТЦ (комплексы I, III, IV) через мембрану наружу переносятся по крайней мере шесть протонов. Как будет показано далее, именно в этих трех участках окислительные процессы в ЭТЦ сопрягаются с-синтезом АТР. Передача 2е- от сукцината на убихинон в комплексе II не сопровождается трансмембранным переносом протонов. Это приводит к тому, что при использовании сукцината в качестве дыхательного субстрата в ЭТЦ
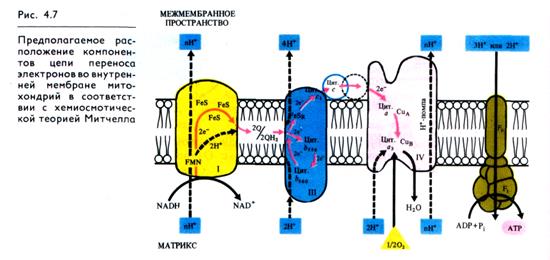
остаются лишь два участка, в которых функционирует протонная помпа.
Особенностью растительных митохондрий (отличающей их от митохондрий животных) является способность окислять экзогенный NADH, т. е. NADH, поступающий из цитоплазмы. Это окисление осуществляется по крайней мере двумя флави-новыми NADH-дегидрогеназами, из которых одна локализована на наружной стороне внутренней мембраны митохондрий, а другая — в их наружной мембране. Первая из них передает электроны в ЭТЦ митохондрий на убихинон (см. рис. 4.6), а вторая — на цитохром с. Для функционирования NADH-дегидрогеназы на наружной стороне внутренней мембраны необходимо присутствие кальция.
 Другое существенное отличие растительных митохондрий состоит в том, что во внутренней мембране помимо основного (цитохромного) пути переноса электронов имеется альтернативный путь переноса е- устойчивый к действию цианида (см. рис. 4.6).
Другое существенное отличие растительных митохондрий состоит в том, что во внутренней мембране помимо основного (цитохромного) пути переноса электронов имеется альтернативный путь переноса е- устойчивый к действию цианида (см. рис. 4.6).
Перенос электронов от NADH к молекулярному кислороду через ЭТЦ митохондрий сопровождается потерей свободной энергии. Какова судьба этой энергии? Еще в 1931 г. В. А. Эн-гельгардт показал, что при аэробном дыхании накапливается АТР. Он первый высказал идею о сопряжении между фосфо-рилированием ADP и аэробным дыханием. В 1937—1939 гг. биохимики В. А. Белицер в СССР и Г. Калькар в США установили, что при окислении промежуточных продуктов цикла Кребса, в частности янтарной и лимонной кислот, суспензиями животных тканей исчезает неорганический фосфат и образуется АТР. В анаэробных условиях или при подавлении дыхания цианидом такого фосфорилирования не происходит. Процесс фосфорилирования ADP с образованием АТР, сопряженный с переносом электронов по ЭТЦ митохондрий, получил название окислительного фосфорилирования.
 2015-05-26
2015-05-26 2378
2378
