Важнейшую роль в обмене веществ и трансформации энергии в клетке играют биологические катализаторы белковой природы — ферменты.
Все ферменты по своей химической природе разделяются на два больших класса:
— однокомпонентные
— двухкомпонентные.
Первые состоят исключительно из белка. В молекуле вторых кроме белка имеется небелковая часть. Белковая часть двухкомпонентного фермента носит название апофермента, а небелковая — кофермента. В качестве коферментов выступают, прежде всего, витамины В1, В2 и их различные производные, витамин В6, никотиновая кислота и др., а также металлы (железо, медь, кобальт, марганец и др.).
По месту расположения ферменты делятся на три группы:
эндоферменты. Действуют в клетке, где образовались;
эктоферменты. Участвуют в процессах на цитоплазматической мембране;
экзоферменты. Синтезируются в клетке, выделяются из нее и осуществляют свою работу вне цитоплазматической мембраны, снаружи от нее.
Высшим растениям более всего присущи ферменты первой группы. Так, ферменты фотосинтеза расположены в хлоропластах, дыхания — в митохондриях и т.д.
Ферменты второй и третьей групп особенно большое распространение получили в мире микроорганизмов. Они действуют главным образом в субстрате, на котором поселяются микробы. Поэтому их нередко называют внеклеточными ферментами. Однако и у высших растений наблюдается выделение ферментов из клеток, например из корня — в прикорневую зону (ризосферу) или из щитка зародыша злаков — в эндосперм. Выделению ферментов клетками корней нередко способствуют неблагоприятные внешние условия (анаэробиоз и др.).
Ферменты отличаются следующими общими особенностями:
— большой каталитической активностью, значительно более высокой, чем у неорганических катализаторов (напомним, что катализ — это явление изменения скорости химической реакции или ее возбуждения с помощью катализаторов, химический состав которых и их количество после реакции остаются неизменными);
— специфичностью действия, под которой понимается способность фермента реагировать только с определенными веществами (субстратами) и действовать только на определенные химические связи; иначе эту особенность называют субстратной специфичностью фермента;
— лабильностью, т. е. способностью изменять скорость реакции в зависимости от действия ряда внешних и внутренних условий;
— обратимостью действия — способностью катализировать взаимопротивоположную направленность хода реакции; эта особенность присуща далеко не всем ферментам.
Важной характеристикой любого фермента является константа Михаэлиса. Под этой константой понимается такая концентрация субстрата, при которой скорость ферментативной реакции составляет половину от возможно максимальной концентрации. При малых количествах субстрата скорость ферментативной реакции пропорциональна его концентрации. С возрастанием концентрации субстрата ход реакции ускоряется все в меньшей и меньшей степени, а затем становится независимой от нее (выход кривой на плато) и будет уже определяться концентрацией фермента.
В живой клетке наряду с химической энергией (АТФ) имеется и другой источник унифицированной энергии — физическая (электрическая), которая носит название мембранного потенциала. Он представляет собой разность электрических потенциалов между цитоплазмой клетки и внеклеточной жидкостью.
По современным представлениям, химическая реакция может произойти только тогда, когда молекулы реагирующих веществ будут активированы, т. е. будут
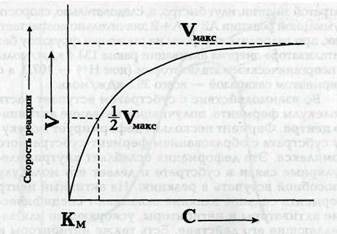
Рис. 1.3. Влияние концентрации субстрата на скорость
реакции, катализируемой ферментом:
С — концентрация субстрата; V — скорость реакции;
Умакс — максимальная скорость реакции;
Км — константа Михаэлиса
иметь определенное дополнительное количество энергии. Без катализатора таких активированных молекул немного и реакции протекают очень медленно. При добавлении катализатора энергия активации, при которой начинается реакция, понижается, а число молекул, которые способны вступить в реакцию, увеличивается. Вместе с этим возрастает и число столкновений молекул между собой, скорость реакции увеличивается. Катализатор снижает энергию активации за счет обходных, дополнительных путей, через ряд промежуточных процессов, требующих меньшее количество энергии. Ниже приводится иллюстрация сказанному.
Реакция распада вещества АВ на А и В без катализатора записывается так:
АВ→А+В.
С катализатором (К) та же реакция будет проходить в несколько этапов:
1) АВ + К→АВК; 2) АВК→ВК + А; 3)ВК→В + К.
Катализатор снова регенерируется в неизменном виде, а промежуточные реакции, проходя с меньшей затратой энергии, идут быстро, и, следовательно, скорость суммарной реакции АВ → А+ В значительно возрастает. Так, при гидролизе сахарозы на глюкозу и фруктозу без катализатора энергия активации равна 134,4 кДж/моль, с неорганическим катализатором (ион Н+) — 107,3, а с ферментом сахаразой — всего 39,5 кДж/моль.
Во взаимодействие с субстратом вступает часть молекулы фермента, получившая название активного центра. Фермент несколько деформирует молекулу субстрата с образованием фермент-субстратного комплекса. Эта деформация ослабляет внутримолекулярные связи в субстрате и делает его молекулу способной вступать в реакцию. На активный центр фермента сильное влияние оказывают специфические активаторы и ингибиторы, ускоряющие или замедляющие его действие. Есть также ингибиторы и активаторы, присоединяющиеся не к активному центру фермента, а к другой его части. При этом изменяется структура молекулы в результате вращения атомов или групп атомов вокруг простых связей, а следовательно, и структура активного центра. В результате этих конформационных перестроек происходит ослабление или усиление активности фермента. Участок молекулы фермента, к которому присоединяются ингибиторы или активаторы (эффекторы), вызывающие изменение структуры активного центра, носит название аллостерического центра.
На скорость ферментативных реакций наиболее сильное влияние из внешних факторов оказывают температура и рН среды.
С повышением температуры до определенных значений скорость ферментативной реакции возрастает, затем, достигнув максимальной величины, начинает падать. Для большинства ферментов это 40 — 50°С. Начиная с 50°С и выше скорость ферментативной реакции снижается из-за потери активности фермента вследствие нарушения структуры белка, его денатурации. При этом восстановление активности с наступлением в последующем оптимальной температуры не происходит в отличие от действия пониженных температур, когда перенесение тканей в условия с благоприятной температурой восстанавливает свойственную ферментам активность.
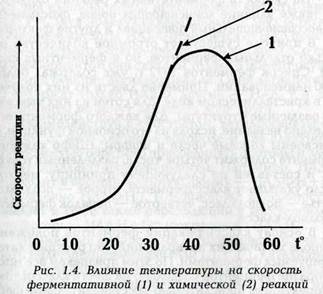
Сопоставление скоростей ферментативных и химических реакций при изменении температуры показывает — до момента достижения максимальной скорости работы фермента зависимость скорости химической реакции одинакова с ферментативной, а затем первая продолжает повышаться, в то время как ферментативная из-за денатурации белка ферментов резко падает.
Большинство ферментов полностью инактивируется при температуре 60°С. Встречаются и довольно устойчивые ферменты, например рибонуклеаза или пероксидаза хрена. После промораживания активность ферментов восстанавливается, поэтому в замороженном состоянии можно достаточно долго хранить ферменты вне клетки. В целом белки-ферменты более устойчивы к температуре, чем структурные белки цитоплазмы.
Значительная часть ферментов действует с наибольшей скоростью при реакции среды слабокислой или близкой к нейтральной. Вместе с тем, почти каждый фермент имеет свои кардинальные точки рН среды. Поэтому кислотность внутри клетки является одним из важнейших факторов регуляции обмена веществ.
На скорость ферментативных реакций оказывают также влияние концентрация ионов, окислительно-восстановительный потенциал и другие факторы.
В природе существует огромное количество не только отдельных ферментов, но и ферментных систем. Список ферментов 1972 г. уже содержал более 2000 наименований. Примерно двести из них получены в кристаллическом виде. Для сотен из них выяснены различные структуры. Для каждого фермента определено название, исходя из его основной функции, и присвоены кодовые числа и шифры. Шифр каждого фермента содержит четыре числа, разделенных точками, и составлен по следующему принципу: первое число указывает класс фермента, второе — подкласс, третье — подподкласс, четвертое — порядок фермента в подпод-классе.
В основу классификации ферментов положена природа химических превращений, тип реакций, катализируемых ферментами. По этим признакам все многообразие ферментов раздельно на шесть классов: оксидоредуктазы (окислительно-восстановительные ферменты); трансферазы; гидролазы (гидролитические ферменты); лиазы; изомеразы; лигазы (синтетазы).
1. К оксидоредуктазам относятся ферменты, катализирующие реакции окисления и восстановления. Они переносят протон или электрон от одного субстрата к другому, окисляя первый и восстанавливая второй. Эти ферменты участвуют во всех процессах биологического окисления — дыхания и брожения. Схему действия оксидоредуктаз можно изобразить следующим образом: RH2 + A ↔ R-+AH2 или R- + A ↔ R+A.
Из этого класса ферментов особо следует выделить дегидрогеназы, катализирующие реакции отщепления водорода от одного вещества и перенос его к другому. Первое вещество в данном случае называется донором водорода, а второе — акцептором его. Дегидрогеназы разделяют на флавиновые и пиридиновые.
— Пиридиновые дегидрогеназы. Их называют анаэробными, так как они непосредственно кислороду передавать водород не могут.
Коферментами пиридиновых дегидрогеназ являются никотинамидадениндинуклеотид-фосфат (НАДФ) и никотинамидадениндинуклеотид [НАД]. НАД представляет собой динуклеотид, состоящий из азотистого основания аденина, амида никотиновой кислоты (витамина РР), двух молекул сахара рибозы и двух остатков фосфорной кислоты. НАДФ отличается от НАД присутствием третьего остатка фосфорной кислоты. Со своим апоферментом они связаны только в момент осуществления реакции дегидрирования. Одни дегидрогеназы содержат только НАДФ, другие — НАД, т. е. эти коферменты не могут замещать друг друга.
Взаимодействуя с субстратом, дегидрогеназы отнимают от него два иона водорода и два электрона. Способностью обратимо присоединять протоны и электроны обладают их коферменты. Например, НАДФ переходит в восстановленную форму — НАДФ Н + Н+ (сокращенно НАДФН2). Подобной же способностью обладает и НАД, также переходящий в восстановленную форму — НАДН + Н+ (сокращенно НАДН2).
Примерами анаэробных дегидрогеназ можно назвать малатдегидрогеназу (КФ 1.1.1.37), катализирующую превращение яблочной кислоты в щавелево-уксусную, и алкогольдегидрогеназу (КФ 1.1.1.1), превращающую этиловый спирт (этанол) в уксусный альдегид.
— Флавиновые дегидрогеназы. Их называют еще аэробными дегидрогеназами, ибо они могут передавать отнятый от донора водород кислороду воздуха.
Коферментами флавиновых дегидрогеназ являются флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН). ФАД и ФМН являются нуклеотидами, содержащими пятиутлеродный спирт D-рибит (рибитол) и азотистое основание рибофлавин (витамин В2), обладающий способностью обратимого присоединения водорода. В составе ФАД находятся два нуклеотида, один из которых содержит остатки D — рибита, фосфорной кислоты и флавина, другой — остатки аденина, рибозы и фосфорной кислоты. Состав ФМН представлен D — рибитом, остатком фосфорной кислоты и флавином. Восстановленная форма ФАД обозначается как ФАДН2, а ФМН — ФМНН2. Со своим апоферментом флавиновые коферменты связаны значительно прочнее, чем пиридиновые. Другим отличием флавиновых дегидрогеназ является наличие в составе их апоферментов металлов (железа, марганца, меди, молибдена).
Представителями аэробных дегидрогеназ являются оксидазы, для которых акцептором водорода служит исключительно кислород воздуха. Отщепляя водород от окисляемого вещества АН2 и передавая его кислороду, оксидаза образует воду или перекись водорода: АН2 + О2 → А + Н2О2. Среди оксидаз в растительном мире широкое распространение получили полифенолоксидаза (КФ 1.10.3.1) и аскорбатоксидаза (КФ 1.10.3.3). Обе представлены белком, содержащим в качестве кофермента медь. Первая окисляет дифенолы С6Н4(ОН)2, вторая превращает аскорбиновую кислоту в дегидроаскорбиновую. Важную роль в жизни растений выполняет цитохромоксидаза (КФ 1.9.3.1), которая активирует молекулярный кислород, перенося на него электроны от цитохромной системы.
Нельзя не отметить и пероксидазу (КФ 1.11.1.7), осуществляющую окисление органических веществ с помощью перекиси водорода, с которой она образует комплексное соединение и приобретает способность быть акцептором водорода. Пероксидаза широко распространена в мире растений и играет важную роль в превращении полифенолов и ароматических аминов.
К классу оксидоредуктаз относят и фермент каталазу (КФ 1.11.1.6), осуществляющую расщепление перекиси водорода на воду и молекулярный кислород: 2Н2О2 → 2Н2О + О2. Физиологическая роль каталазы состоит, прежде всего, в том, что она предотвращает накопление значительных количеств перекиси водорода, так как последняя ядовита для клеток.
2. Трансферазы — ферменты, катализирующие реакции переноса химических групп между молекулами веществ: метальные (метпилтрансферазы), аминные (аминотрансферазы), фосфатные (фосфотрансферазы) и многие другие. Фосфотрансферазы, для которых донором фосфатных групп служит АТФ, называются киназами. Схема действия всех трансфераз:
RX + A↔ R + AX.
3. Гидролазы катализируют реакции гидролитического, т. е. с участием воды, распада веществ:Этот класс делится на подклассы:
— эстеразы — ферменты, расщепляющие сложные эфиры (липазы, фосфатазы и др.);
— карбогидразы — катализируют реакции гидролиза сложных углеводов (амилаза, малыпаза, сахараза и др.);
— пептидогидролазы (протеазы или пептидазы) —участвуют в расщеплении пептидной связи в белках (СО-NH).
4. Лиазы — ферменты, катализирующие реакции расщепления веществ без участия воды, т. е. негидролитическим путем, а также присоединения функциональных групп по двойным связям: R1R2→ R1+R2
В частности, для декарбоксилаз — ферментов, отщепляющих СО2, эту реакцию можно записать таким образом: R-COOH →RH + СО2.
Так, например, фермент пируватдекарбоксилаза (КФ 4.1.1.1) отщепляет молекулу углекислоты от пировиноградной кислоты с образованием уксусного альдегида: СН3-СО-СООН→СН3-СНО + СО2.
5. Ферменты, катализирующие процессы изомеризации, — изомеразы осуществляют реакции превращения веществ в их изомеры. Например, рибозофосфат-изомераза (КФ 5.3.1.6) превращает рибозо-5-фосфат в рибулозо-5-фосфат; триозофосфат-изомераза (КФ5.3.1.1) осуществляет превращение фосфоглицеринового альдегида в диоксиацетонфосфат.
6. Лигазы, или синтетазы, осуществляют реакции синтеза разнообразных веществ. Известно, что все синтетические процессы требуют затраты энергии и поэтому протекают только при участии АТФ:
R1 + R2 + АТФ → R1R2 + АДФ + Н3РО4.
Например, пируваткарбоксилаза (КФ 6.4.1.1) осуществляет реакцию синтеза щавелево-уксусной кислоты из пировиноградной кислоты и СО2:
СН3 - СО - СООН + СО2 + АТФ + Н2О → СООН - СО - СН2 - СООН + АДФ + Н3РО4. В данном классе следует отметить и ферменты, участвующие в реакциях присоединения остатков аминокислот к транспортной РНК в процессе синтеза белка. Так, под действием аланил-тРНК-синте-тазы (КФ 6.1.1.7) образуется комплекс аланина и тРНК:
АТФ + аланин + тРНК → аланин-тРНК + АМФ (аденозинмонофосфат) + Н2РО4
 2015-05-26
2015-05-26 5511
5511