Сплав - это система, состоящая из нескольких компонентов.
Компоненты в сплаве могут группироваться, передвигаться, обмениваться энергией, но всегда стремятся занять равновесное (устойчивое) положение с минимальным запасом свободной энергии.
Компонентами сплава в большинстве случаев являются металлы, причем компонентами считаются только те из них и в таком количестве, когда они заметно влияют на свойства сплава. Таким образом, изменяя количество компонентов в сплаве, можно конструировать материал с необходимыми свойствами.
По взаимодействию компонентов сплавов в твёрдом состоянии они делятся на твердые растворы, механические смеси и химические на соединения.
В твёрдых растворах кристаллические решетки компонентов похожи и в узлах одной кристаллической решетки расположены атомы разных компонентов.
В механических смесях компоненты не взаимодействуют и каждый компонент образует свой кристалл (зерно) со своей кристаллической решеткой (получается механическая смесь зерен компонентов).
|
|
|
В химических соединениях компоненты взаимодействуют, образуя химическое соединение с новой кристаллической решеткой (не похожей на решетки компонентов).
В твёрдом состоянии сплавы состоят из одной или нескольких фаз (они разного строения, формы, химического состава и количества) и часто включают в себя химические соединения. Кристаллические решетки, т.е. расположение атомов и расстояние между ними определены для 150 тыс. фаз и химических соединений [1].
Фазой в сплаве называется однородная его часть, отделённая от других частей поверхностью раздела (границей), при переходе через которую скачкообразно изменяются свойства. От чего могут резко измениться свойства? Только оттого, что через границу совсем другое строение и химический состав соседней части сплава.
Для десятков тысяч сплавов построены диаграммы состояния. Они показывают физическое состояние и строение сплава в зависимости от концентрации компонентов (химического состава) и температуры.
Анализ диаграмм состояния сплавов позволяет судить об их технологических и физических свойствах.
Диаграммы состояния сплавов строятся разными методами. В данной работе для построения диаграммы состояния используют термический метод.
Рассмотрим диаграмму состояния сплавов системы Cu-Ni (твердые растворы), изображённую на рисунки 1.
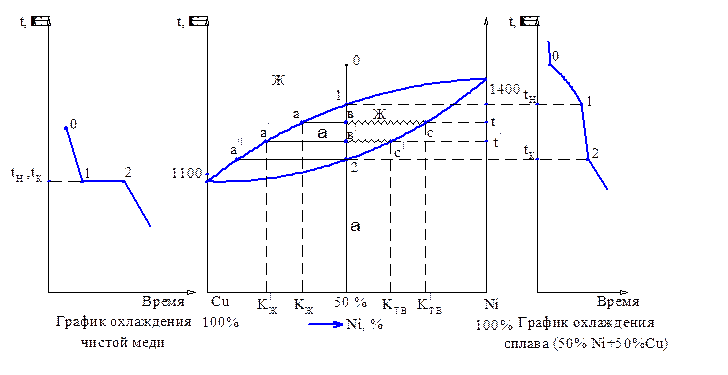
Рисунок 1 - Диаграмма состояния сплавов системы Cu-Ni и графики охлаждения
Из рисунка 1 следует:
- резкие изломы на графике охлаждения сплава, состоящего из 50% Ni и 50% Cu, в точках 1 и 2 свидетельствуют о резком изменении скорости охлаждения, что возможно только при изменении свойств сплава, в результате изменения строения сплава. Следовательно, при температуре точки 1 и 2 изменится строение сплава. При его охлаждении при tн появляется твёрдая фаза, т.е. начинается кристаллизация. При температуре точки 2 tк затвердела последняя капля жидкого расплава и закончилась кристаллизация;
- чистые компоненты (см. график охлаждения чистой меди) начинают кристаллизацию (затвердевание) в точке 1 (tн) и заканчивает в точке 2 (tк) при постоянной температуре;
- твёрдые растворы (см. график охлаждения сплава (50% Cu + 50% Ni) затвердевают при переменной температуре.
Если взять 1000 сплавов с разным соотношением Cu и Ni, получим по 1000 точек 1 и 2. Соединяя точки 1, получим линию ликвидус – температуры начала кристаллизации сплавов при охлаждении и конца расплавления при нагревании. Точки 2 дадут нам линию солидус – температуры конца кристаллизации при охлаждении и начала расплавления при нагревании сплавов. В этом суть термического метода построения диаграмм состояния сплавов.
|
|
|
Между линиями ликвидус и солидус (температуры tн и tк) существуют две фазы - жидкая (ж) и твёрдая (a). Длина горизонтальных отрезков соответствует количеству этих фаз при данной температуре t, а перпендикуляр, опущенный из точки пересечения их с линиями диаграммы, - соответствует химическому составу этих фаз.
Определяют принадлежность какой-либо фазе по правилу «родился → растёт». Так, при охлаждении сплава 50% Cu + 50 %Ni в точке 1 «родилась» твёрдая фаза (a), следовательно, отрезок, который будет расти с понижением температуры, покажет количество твёрдой фазы a.
Итак, для сплава 50%Ni и 50%Cu:
- при температуре t длина отрезка ac характеризует количество всего сплава, aв – количество твёрдой фазы a, вc – количество жидкой фазы (ж), причем твёрдая фаза имеет концентрацию (химсостав) Ктв, жидкая – Кж;
Количество жидкой фазы при температуре t
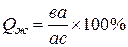 ; (1)
; (1)
количество твердой фазы при температуре t
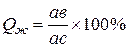 ; (2)
; (2)
- при понижении температуры до t! имеем: а! с!- количество всего сплава; а! в! – количество твердой фазы a (увеличилось); в! с! – количество жидкой фазы Ж (уменьшилось); изменилась и концентрация этих фаз (см. проекции точек а!, с! на ось концентраций);
- при понижении температуры до точки 2 (tк): а!! в!! – количество всего сплава; a= а!! в!!; Ж = 0 (закристаллизировалась последняя капля Ж), т.е. сплав полностью твёрдый, и его состав соответствует точке в!! (точке 2), т.е. (50% Cu + 50% Ni).
Рассмотрим диаграмму состояния сплавов системы Рb – Sb (эти металлы образуют сплав – механическую смесь чистых компонентов), изображённую на рис. 2.
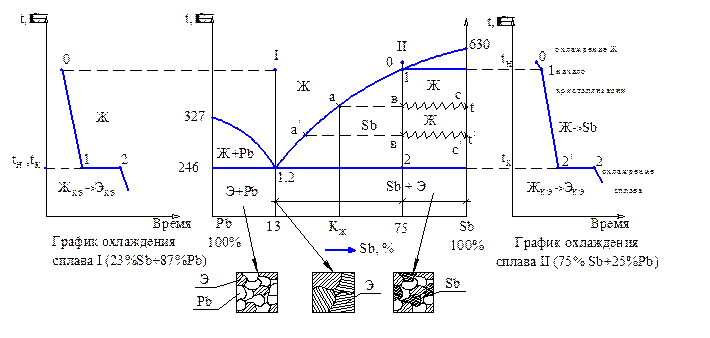
Рисунок 2 - Диаграмма состояния сплавов системы Pb - Sb и график охлаждения сплавов I и II
- Имеется такая концентрация компонентов (см сплав I), которая называется эвтектической (Кэ) и при которой кристаллизация начинается (точка 1) и заканчивается (точка 2) при постоянной и наименьшей температуре 246ºС для данной системы (см. график охлаждения сплава I). При этом одновременно образуется механическая смесь компонентов, которая называется эвтектикой (Э);
- при температурах выше линии ликвидус (верхняя линия на любой диаграмме) сплавы находятся в жидком состоянии (Ж), а при температурах ниже линии солидус (сверху вторая линия на любой диаграмме), - в твёрдом состоянии. При температурах между этими линиями есть твёрдая и жидкая фазы.
- при охлаждении сплава II имеем: при температуре точки 1 (tн) начинается кристаллизация (родилась твёрдая фаза); при понижении температуры до t имеется ас – количество всего сплава, количество твёрдой фазы равно ав, жидкой – вc, причем концентрация жидкой фазы определяется проекцией точки а (Кж), твёрдой фазы - проекцией точки с, т.е. твёрдая фаза Sb 100% = зерна чистого Sb; при температуре t! – a! в! (родился → растёт) = количество зерен Sb (растет), в! c! – количество жидкой фазы Ж, причем концентрация Ж определяется проекцией точки а!. При температуре точки 2 (tк) концентрация остатка Ж будет равна Кэ, и из неё будет образовываться эвтектика (Э) при постоянной температуре (см. на графике охлаждения сплава II участок 2’ – 2). Следовательно, при температурах ниже точки 2 (tк) имеем структуру: зерна Sb, выделившиеся из жидкого расплава, + эвтектика (Э).
|
|
|
 2015-05-26
2015-05-26 1361
1361








