Электролиты – это вещества, полностью или частично распадающиеся на ионы в растворе или расплаве.
Распад на ионы под действием полярных молекул растворителя называется электролитической диссоциацией.
Сила электролита определяется степенью его диссоциации:
α = Nрасп/Nнач., (2.1)
где Nнач – число молекул в исходном растворе, Nрасп. – число молекул, распавшихся на ионы. Различают слабые (α < 5%) и сильные электролиты.
Процесс диссоциации слабых электролитов обратим и к нему применим закон действия масс:
КА ↔ К+ + А-
Состояние равновесия характеризуется константой равновесия, которая не зависит от концентрации электролита, а зависит от его природы и температуры:
Кдиссоц.= [K+][A-]/ [KA] (2.2)
Степень диссоциации и константа диссоциации связаны между собой законом разведения Оствальда:
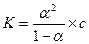 (2.3),
(2.3),
Где с – молярная концентрация, моль/л. Если с <<1 (очень слабые электролиты), то степенью диссоциации в знаменателе можно пренебречь, тогда:
Кдиссоц= α2 с (2.4)
Сильные электролиты диссоциируют в водных растворах практически нацело. Однако активность ионов в значительной степени зависит от концентрации раствора, радиуса гидратированных ионов, заряда ионов. Это приводит к торможению движения ионов в растворе, снижению их активности. Для оценки способности ионов к химическим действиям в растворе вместо концентрации вводится понятие активность.
|
|
|
Активность – эффективная или условная концентрация, соответственно которой электролит ведет себя в химических реакциях:
а = γ с (2.5),
где γ – коэффициент активности, величина, зависящая от ионной силы раствора. Для электролита, состоящего из однозарядных катиона и аниона, АВ активность можно рассчитать по формуле:
а(АВ) = а+ а- = с2γ +γ - (2.6)
Средняя активность электролита а± = √а+ а- (2.7)
Для электролита с разными зарядами катиона и аниона AmBn:
а± = 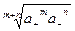 (2.8)
(2.8)
Ионная сила раствора (μ) является мерой электростатического взаимодействия между ионами в растворе:
μ = ½ (с1z12 + c2 z22 + … + ci zi2) (2.9),
где z – заряды ионов, с – концентрация ионов, моль/л.
Коэффициент активности можно рассчитать из ионной силы раствора по уравнению Дебая-Хюккеля:
lg γ± = 0,5 z2√μ (2.10)
Степень отклонения экспериментальных данных от рассчитанных теоретически учитывает «кажущаяся степень диссоциации»:
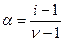 (2.11),
(2.11),
где 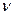 - число ионов, на которые диссоциирует электролит, i – изотонический коэффициент Вант – Гоффа. Он показывает, во сколько раз экспериментально найденные значения коллигативных свойств: осмотического давления, понижения давления паров над раствором, снижения температуры замерзания и повышения температуры кипения раствора электролита превышают ту же величину для раствора неэлектролита той же начальной концентрации:
- число ионов, на которые диссоциирует электролит, i – изотонический коэффициент Вант – Гоффа. Он показывает, во сколько раз экспериментально найденные значения коллигативных свойств: осмотического давления, понижения давления паров над раствором, снижения температуры замерзания и повышения температуры кипения раствора электролита превышают ту же величину для раствора неэлектролита той же начальной концентрации:
|
|
|
i = πэксперим./πвычисл. (2.12)
Сопоставляя значения ν и i, можно оценить меру отклонения раствора электролита от идеального: 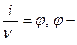 осмотический коэффициент.
осмотический коэффициент.
Вывод: Для растворов электролитов в математические выражения законов Вант – Гоффа и Рауля вводится поправочный - изотонический коэффициент i = 1 + α(ν-1):
π V = i nRT (2.12)
Δp = i po n/no (2.13)
ΔТ = i К сm (2.14)
 2015-05-26
2015-05-26 1090
1090








