Ионы ОН- в растворе определяют щелочную среду.
1. Растворы щелочей изменяют окраску индикаторов:
Фенолфталеин: малиновый,
Лакмус: синий,
Метилоранж: жёлтый.
1. Растворы щелочей взаимодействуют с кислотными оксидами с образованием солей тех кислот, которые соответствуют реагирующим кислотным оксидам. В зависимости от количества щёлочи образуются средние или кислые соли. Например, при взаимодействии гидроксида кальция с оксидом углерода(IV) образуются карбонат кальция и вода:
Ca(OH)2 + CO2 = CaCO3? + H2O
Ca2+ + 2OH- + CO2 = CaCO3 + H2O
А при взаимодействии гидроксида кальция с избытком оксида углерода(IV) образуется гидрокарбонат кальция:
Ca(OH)2 + CO2 = Ca(HCO3)2
Ca2+ + 2OH- + CO2 = Ca2+ + 2HCO32-
1. Все основания взаимодействуют с кислотами с образованием соли и воды, например: при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода:
NaOH + HCl = NaCl + H2O
Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O
OH- + H+ = H2O.
Гидроксид меди(II) растворяется в соляной кислоте с образованием хлорида меди(II) и воды:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
|
|
|
Cu(OH)2 + 2H+ + 2Cl- = Cu2+ + 2Cl- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2О.
Реакция между кислотой и основанием называется реакцией нейтрализации.
1. Нерастворимые основания при нагревании разлагаются на воду и соответствующий основанию оксид металла, например:
Cu(OH)2 = CuO + H2 2Fe(OH)3 = Fe2O3 + 3H2O
1. Щёлочи вступают во взаимодействие с растворами солей, если выполняется одно из условий протекания реакции ионного обмена до конца (выпадает осадок), например: при взаимодействии гидроксида натрия с раствором сульфата меди(II) образуется осадок гидроксида меди(II).
2NaOH + CuSO4 = Cu(OH)2? + Na2SO4
2OH- + Cu2+ = Cu(OH)2
Реакция протекает за счёт связывания катионов меди с гидроксид-ионами.
При взаимодействии гидроксида бария с раствором сульфата натрия образуется осадок сульфата бария.
Ba(OH)2 + Na2SO4 = BaSO4? + 2NaOH
Ba2+ + SO42- = BaSO4
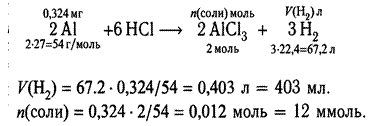 |
Реакция протекает за счёт связывания катионов бария и и сульфат-анионов.
Один лист
Билет № 10
1. Щёлочи — это растворимые основания.
С точки зрения теории электролитической диссоциации основаниями являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов, т.е. основные гидроксиды:
NaOH → Na+ + OH−
Более строгая формулировка: отщепляющие в качестве анионов (отрицательных ионов) только гидроксид-ионы.
Растворы щелочей окрашивают индикатор фенолфталеин (сокращенно ф-ф) в малиновый цвет.
Лакмус окрашивают в синий, метилоранж — в желтый, но это в школьной лаборатории видно плохо, не дает возможности отличить от нейтрального раствора.
Щёлочи реагируют с кислотами с образованием соли и воды (реакция нейтрализации):
NaOH + HCl = NaCl + H2O
Щёлочи реагируют с кислотными оксидами с образованием соли и воды:
|
|
|
2NaOH + CO2 = Na2CO3 + H2O
Ca(OH)2 + CO2 = CaCO3↓ + H2O (известковое тесто при неправильном хранении поглощает углекислый газ, образуется карбонат кальция)
Щелочи реагируют с растворами солей, если в результате реакции образуется осадок:
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
Например, при сливании с растворимыми солями меди (II) выпадает синий осадок гидроксида меди (II).
При нагревании солей аммония со щелочами выделяется газообразный аммиак:
Ca(OH)2 + 2NH4Cl = CaCl2 + 2NH3↑ + 2H2O


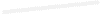 2.
2. 
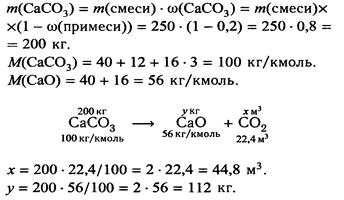
Билет №11:
Соли – это электролиты, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков.
NaCl = Na+ + Cl-. K2SO4 = 2K+ + SO42- Mg(NO3)2 = Mg2+ + 2NO3-
Общие химические свойства солей характеризуются их взаимодействием с кислотами, щелочами, металлами и солями.
1. Соли взаимодействуют с кислотами, если образуется:
a) летучая кислота: CaCO3 + 2HCl = CaCl2 + H2O + CO2, CaCO3 + 2H+ = Ca2+ + H2O + CO2;
b) нерастворимая кислота: Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3?, SiO32- + 2H+ = H2SiO3;
c) соль, нерастворимая в воде и образующейся кислоте:
AgNO3 + HCl = AgCl? + HNO3, Ag+ + Cl- = AgCl.
1. Растворимые соли взаимодействуют со щелочами, если одно из образующихся веществ выпадает в осадок: CuSO4 + 2NaOH = Cu(OH)2? + Na2SO4 Cu2+ + 2OH- = Cu(OH)2,
Na2SO4 + Ba(OH)2 = BaSO4? + 2NaOH SO42- + Ba2+ = BaSO4
1. Более активные металлы вытесняют менее активные металлы из растворов их солей, за исключением металлов, реагирующих с водой: CuSO4 + Zn = ZnSO4 + Cu
Cu + ZnSO4 = --------------
!!! При взаимодействии растворов солей со щелочными металлами образуется новая соль, нерастворимое основание и водород, т.к. в реакции участвует вода из раствора:
Na + CuSO4 + H2О = …………………..
2Na + 2H2O = 2NaOH + H2
2NaOH + CuSO4 = Cu(OH)2? + Na2SO4
2Na + CuSO4 + 2H2O = H2 + Cu(OH)2? + Na2SO4
1. Растворы солей реагируют между собой, если происходит связывание ионов.
Если связывания ионов не происходит, то говорят, что реакция идёт не до конца:
CuSO4 + BaCl2 = CuCl2 + BaSO4 SO42- + Ba2+ = BaSO4?
есть связывание ионов, реакция идёт до конца.
K2SO4 + 2NaCl = Na2SO4 + 2KCl
2K+ + SO42- + 2Na+ + 2Cl- = 2Na+ + SO42- + 2K+ + 2Cl-
нет связывания ионов, реакция идёт не до конца.
Многие соли имеют большое практическое значение. Например, хлорид натрия NaCl или поваренная соль, каменная соль, пищевая соль – ценнейшее химическое сырьё. Его используют при получении соды, хлороводорода. При электролизе водного раствора хлорида натрия получают гидроксид натрия, хлор и, попутно, водород, а при электролизе расплава хлорида натрия получают металлический натрий и хлор. Хлорид натрия применяют при первичной обработке кож, при подготовке тканей к крашению, как консервант в пищевой промышленности, как вкусовую добавку в пищу. В дорожном хозяйстве для предотвращения обледенения асфальта. Всего хлорид натрия используют более чем в 1500 производствах различных веществ и материалов.
Карбонат натрия Na2CO3 или кальцинированная сода, сода, стиральная сода. Его применяют при производстве стекла, мыла и моющих средств, при варке целлюлозы, как нейтрализующее вещество при обработке кислых растворов.
Карбонат калия, K2CO3 поташ применяют при варке оптического стекла, жидкого мыла, минеральных красок, получении многих соединений калия.
Карбонат кальция CaCO3 – распространённое в природе вещество: минерал кальцит, горная порода известняк и его разновидности – мел, мрамор, туф. Применяется для производства негашёной извести, цемента, стекла, минеральных удобрений, как наполнитель при изготовлении «мелованной» бумаги и резины, строительный камень (щебень) и компонент бетона и шифера, в виде осаждённого порошка – для изготовления школьных мелков, зубных порошков и паст, в побелке помещений.
2. (Опыт):
1. Добавить к смеси немного воды, перемешать. Соль растворится, песок осядет на дно.
2. Профильтровать полученную смесь. Если нет фильтра, дать отстояться и слить верхнюю часть воды с растворенной солью.
(Здесь мы используем различную растворимость соли и песка в воде)
|
|
|
3.Выпарить соль из раствора в фарфоровой чашке.
Прекратить выпаривание при появлении кристаллов соли, иначе чашка может треснуть. С горячей чашкой обращаться осторожно!!! Спиртовку тушить, накрывая колпачком. Спички чиркать «от себя».
Билет № 12:
1. Вода состоит из молекул. Каждая молекула содержит два атома водорода, соединенные ковалентными связями с одним атомом кислорода. Молекула воды имеет угловую форму и образована по типу ковалентной полярной химической связи. Угол между связями около 105º
Поскольку кислород является более электроотрицательным элементом (сильным окислителем), общая электронная пара ковалентной связи смещается к атому кислорода, на нем образуется частичный отрицательный заряд δ−, на атомах водорода — частичный положительный δ+. Соседние молекулы притягиваются друг к другу противоположными зарядами — это обуславливает сравнительно высокую температуру кипения воды.
Вода при комнатной температуре — бесцветная прозрачная жидкость. Температура плавления 0º C, температура кипения при атмосферном давлении — 100º С. Чистая вода не проводит электрический ток.
Интересной особенностью воды является то, что она имеет наибольшую плотность 1 г/см3 при температуре около 4º С. При дальнейшем понижении температуры плотность воды снижается. Поэтому с наступлением зимы верхние замерзающие слои воды становятся легче и не погружаются вниз. Лед образуется на поверхности. Промерзания водоема до дна обычно не происходит (к тому же лед тоже имеет плотность меньше воды и плавает на поверхности).
Химические свойства:
1. Вода разлагается при пропускании электрического тока* на водород и кислород:
2H2O = 2H2↑ + O2↑
2. Вода взаимодействует с натрием и некоторыми другими активными металлами, которые вытесняют из нее водород, образуется щелочь (гидроксид натрия):
2Na + 2HOH = 2NaOH + H2↑
Сa+H2O=Сa(OH)2+H2
3. Оксид кальция (негашеная известь) бурно взаимодействует с водой (гасится) с выделением большого количества тепла, что может быть даже причиной пожара. Образуется гидроксид кальция (гашеная известь):
CaO + H2O = Ca(OH)2
|
|
|
4. Большинство оксидов неметаллов реагируют с водой с образованием кислот. Оксид серы (IV) взаимодействует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO3
Эта реакция характерна для всех кислотных оксидов,за исключением оксида кремния SiO2,который с водой не взаимодействует.
К основным загрязнителям природной воды относятся сточные воды промышленных предприятий, содержащие соединения ртути, мышьяка и других токсичных элементов. Стоки животноводческих комплексов, городов могут содержать отходы, вызывающие бурное развитие бактерий. Большую опасность для природных водоемов представляет неправильное хранение (не обеспечивающее защиту от атмосферных осадков) или применение удобрений и ядохимикатов, смываемых в водоемы. Транспорт, особенно водный, загрязняет водоемы нефтепродуктами и бытовым мусором, выбрасываемым недобросовестными людьми прямо в воду.
Для охраны вод необходимо вводить замкнутое водоснабжение промышленных предприятий, комплексную переработку сырья и отходов, строительство очистных сооружений, экологическое воспитание населения.
2. (Опыт): Водород можно получить взаимодействием цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2↑
Водород легче воздуха, поэтому его собирают в пробирку, перевернутую дном кверху.
Чтобы доказать наличие водорода в пробирке и проверить его на чистоту, пробирку с водородом подносят к пламени спиртовки (пробирку держим держателем для пробирок!). Чистый водород сгорает со звонким хлопком.
Если водород смешан с воздухом, звук будет визгливый, говорят «сгорает со свистом».
Опыт доказательства наличия водорода не всегда получается, особенно без тренировки – нужно накопить довольно много водорода. При этом не забывайте отверстие пробирки направлять в сторону, где никого нет – «от людей».
Для получения водорода на экзамене предложат пробирку с газоотводной трубкой или колбу, накрытую перевернутой воронкой. Желательно уточнить этот момент на консультации перед экзаменом и обговорить с учителем меры безопасности.
Билет № 13:
1. Оксидами называются сложные вещества, в состав молекул которых входят атомы кислорода в степни окисления – 2 и какого-нибудь другого элемента.
Оксиды могут быть получены при непосредственном взаимодействии кислорода с другим элементом, так и косвенным путём (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твёрдом, жидком и газообразном состоянии, этот тип соединений весьма распространён в природе. Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
 2015-05-30
2015-05-30 2539
2539








