Введение
Все микробиологические, биохимические и моле-кулярно-биологические исследования микроорганизмов проводят в специальных лабораториях, структура и оборудование которых зависят от объектов исследования (бактерий, вирусов, грибов, простейших), а также от их целевой направленности (научные исследования, диагностика заболеваний). Изучение иммунного ответа и серодиагностика заболеваний человека и животных осуществляют в иммунологических и серологических (serum — сыворотка крови) лабораториях.
Бактериологические, вирусологические, микологические и серологические (иммунологические) лаборатории входят в состав санитарно-эпидемиологических станций (СЭС), диагностических центров и крупных больниц. В лабораториях СЭС выполняют бактериологические, вирусологические и серологические анализы материалов, полученных от больных и контактировавших с ними лиц, обследуют бактерионосителей и проводят санитарно-микробиологические исследования воды, воздуха, почвы, пищевых продуктов и т.д.
|
|
|
В бактериологических и серологических лабораториях больниц и диагностических центров проводят исследования с целью диагностики кишечных, гнойных, респираторных и других инфекционных заболеваний, осуществляют микробиологический контроль за стерилизацией и дезинфекцией.
Диагностику особо опасных инфекций (чума, туляремия, сибирская язва и др.) проводят в специальных режимных лабораториях, организация и порядок деятельности которых строго регламентированы.
В вирусологических лабораториях диагностируют заболевания, вызванные вирусами (грипп, гепатит, полиомиелит и др.), некоторыми бактериями — хламидиями (орнитоз и др.) и риккетсиями (сыпной тиф, Ку-лихорадка и др.). При организации и оборудовании вирусологических лабораторий учитывают специфику работы с вирусами, культурами клеток и куриными эмбрионами, требующую строжайшей асептики.
В микологических лабораториях проводят диагностику заболеваний, вызываемых патогенными грибами, возбудителями микозов.
Лаборатории обычно размещаются в нескольких помещениях, площадь которых определяется объемом работ и целевым назначением.
В каждой лаборатории предусмотрены:
а) боксы для работы с отдельными группами возбудителей;
б) помещения для серологических исследований;
в) помещения для мойки и стерилизации посуды, приготов
ления питательных сред;
г) виварий с боксами для здоровых и подопытных живот
ных;
д) регистратура для приема и выдачи анализов.
Наряду с этими помещениями в вирусологических лабораториях имеются боксы для специальной обработки исследуемого материала и работы с культурами клеток.
|
|
|
Оборудование микробиологических лабораторий
Лаборатории снабжены рядом обязательных приборов и аппаратов.
1. Приборы для микроскопии: биологический иммерсионный микроскоп с дополнительными приспособлениями (осветитель, фазово-контрастное устройство, темнопольный конденсор и др.), люминесцентный микроскоп.
2. Термостаты и холодильники.
3. Приборы для приготовления питательных сред, растворов и т.д.: аппарат для получения дистиллированной воды (дистиллятор), технические и аналитические весы, рН-метры, аппаратура для фильтрования, водяные бани, центрифуги.
4. Набор инструментов для манипуляций с микробами: бактериологические петли, шпатели, иглы, пинцеты и др.
5. Лабораторная посуда: пробирки, колбы, чашки Петри, матрацы, флаконы, ампулы, пастеровские и градуированные пипетки и др., аппарат для изготовления ватно-марлевых пробок.
Крупные диагностические комплексы имеют автоматические анализаторы и компьютеризированную систему оценки полученной информации.
В лаборатории выделено место для окраски микроскопических препаратов, где находятся растворы специальных красителей, спирт, кислоты, фильтровальная бумага и др. Каждое рабочее место снабжено газовой горелкой или спиртовкой и емкостью с дезинфицирующим раствором. Для повседневной работы лаборатория должна располагать необходимыми питательными средами, химическими реактивами, диагностическими препаратами и другими материалами.
В крупных лабораториях имеются термостатные комнаты для массового выращивания микроорганизмов, постановки серологических реакций. Для выращивания, хранения культур, стерилизации лабораторной посуды и других целей используют следующую аппаратуру.
1. Термостат. Аппарат, в котором поддерживается постоянная температура. Оптимальная температура для размножения большинства патогенных микроорганизмов 37 "С. Термостаты бывают воздушными и водяными.
2. Микроанаэростат. Аппарат для выращивания микроорганизмов в анаэробных условиях.
3. С02 -инкубатор. Аппарат для создания постоянной температуры и атмосферы определенного газового состава. Предназначен для культивирования микроорганизмов, требовательных к газовому составу атмосферы.
4. Холодильники. Используют в микробиологических лабораториях для хранения культур микроорганизмов, питательных сред, крови, вакцин, сывороток и прочих биологически активных препаратов при температуре около 4 °С. Для хранения препаратов при температуре ниже О °С применяют низкотемпературные холодильники, в которых поддерживается температура —20 °С или —75 "С.
5. Центрифуги. Применяют для осаждения микроорганизмов, эритроцитов и других клеток, для разделения неоднородных жидкостей (эмульсии, суспензии). В лабораториях используют центрифуги с различными режимами работы.
6. Сушилъно-стерилизационный шкаф (печь Пастера). Предназначен для суховоздушной стерилизации стеклянной лабораторной посуды и других жаростойких материалов.
7. Стерилизатор паровой (автоклав). Предназначен для стерилизации перегретым водяным паром (под давлением). В микробиологических лабораториях используют автоклавы разных моделей (вертикальные, горизонтальные, стационарные, переносные).
БАКТЕРИОЛОГИЧЕСКИЕ, ВИРУСОЛОГИЧЕСКИЕ, МИКОЛОГИЧЕСКИЕ, ИММУНОЛОГИЧЕСКИЕ ЛАБОРАТОРИИ И ИХ ОБОРУДОВАНИЕ. УСТРОЙСТВО СОВРЕМЕННЫХ МИКРОСКОПОВ. МЕТОДЫ МИКРОСКОПИИ. МЕТОДЫ ИЗУЧЕНИЯ МОРФОЛОГИИ МИКРООРГАНИЗМОВ
- План
- Программа
1. Правила работы и организация микробиологических (бактериологических, вирусологических, микологических) лабораторий.
2. Основные приборы и оборудование микробиологической лаборатории.
|
|
|
3. Микроскопы и микроскопическая техника. Правила работы с иммерсионным микроскопом (объективами).
Демонстрация
1. Устройство и применение основных приборов и оборудования, используемого в микробиологических лабораториях: термостата, центрифуг, автоклава, сушильного шкафа, инструментария и посуды.
2. Устройство биологического микроскопа. Различные методы микроскопии: темнопольная, фазово-контрастная, люминесцентная, электронная.
3. Препараты микробов (дрожжей и бактерий) при различных методах микроскопии.
Задание студентам
1. Микроскопировать и зарисовать препараты дрожже-подобных грибов рода Candida, используя различные виды микроскопии.
Методические указания
Правила работы в микробиологических лабораториях.
Работу в микробиологической лаборатории медицинского учреждения проводят с возбудителями инфекционных заболеваний — патогенными микроорганизмами.
Поэтому для предохранения от заражения персонал обязан строго соблюдать правила внутреннего распорядка:
1. Все сотрудники должны работать в медицинских халатах, шапочках и сменной обуви. Вход в лабораторию без халата категорически воспрещен. В необходимых случаях работающие надевают на лицо маску из марли. Работа с особо опасными микробами регламентируется специальной инструкцией и проводится в режимных лабораториях.
2. В лаборатории запрещается курить и принимать пищу.
3. Рабочее место должно содержаться в образцовом порядке. Личные вещи сотрудников следует хранить в специально отведенном месте.
4. При случайном попадании инфицированного материала на стол, пол и другие поверхности это место необходимо тщательно обработать дезинфицирующим раствором.
5. Хранение, наблюдение за культурами микробов и их уничтожение должны производиться согласно специальной инструкции. Культуры патогенных микробов регистрируют в специальном журнале.
6. По окончании работы руки следует тщательно вымыть, а при необходимости обработать дезинфицирующим раствором.
|
|
|
Микроскопы и методы микроскопии
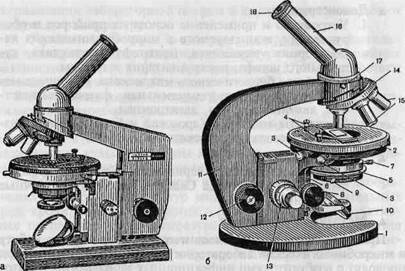
Рис. 1.1. Микроскопы.
а — общий вид микроскопа "Биолам"; б — микроскоп МБР-1: 1 — основание микроскопа; 2 — предметный столик; 3 — винты для перемещения предметного столика; 4 — клеммы, прижимающие препарат; 5 — конденсор; 6 — кронштейн конденсора; 7 — винт, укрепляющий конденсор в гильзе; 8 — рукоятка перемещения конденсора; 9 — рукоятка ирисовой диафрагмы конденсора; 10 — зеркало; 11 — тубусодержатель; 12 — рукоятка макрометричес-кого винта; 13 — рукоятка микрометрического винта; 14 — револьвер объективов; 15 — объективы; 16 — наклонный тубус; 17 — винт для крепления тубуса; 18 — окуляр.
Для микробиологических исследований используют несколько типов микроскопов (биологический, люминесцентный, электронный) и специальные методы микроскопии (фа-зово-контрастный, темнопольный).
В микробиологической практике применяют микроскопы отечественных марок: МБР-1, МБИ-2, МБИ-3, МБИ-6, "Биолам" Р-1 и др. (рис. 1.1). Они предназначены для изучения формы, структуры, размеров и других признаков различных микробов, величина которых не менее 0,2—0,3 мкм.
Иммерсионная микроскопия
Применяется для увеличения разрешающей способности метода световой микроскопии. Разрешающая способность системы светооптической микроскопии определяется длиной волны видимого света и числовой апертурой системы. Числовая апертура показывает величину угла максимального конуса света, попадающего в объектив, и зависит от оптических свойств (преломляющей способности) среды между объектом и линзой объектива. Погружение объектива в среду (минеральное масло, вода), имеющую высокий коэффициент преломления, близкий к таковому стекла, препятствует рассеянию света от объекта.
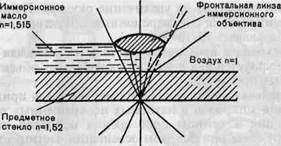
Рис. 1.2. Ход лучей в иммерсионной системе, п — показатель преломления.
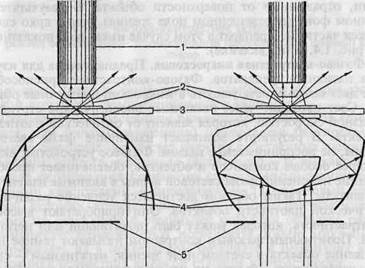
Рис. 1.3. Ход лучей в темнопольных конденсорах, а — параболоид-конденсор; б — кардиоид-конденсор; 1 — объектив; 2 — иммерсионное масло; 3 — препарат; 4 — зеркальная поверхность; 5 — диафрагма.
Таким образом достигается увеличение числовой апертуры и соответственно разрешающей способности. Для иммерсионной микроскопии применяют специальные иммерсионные объективы, снабженные меткой (МИ — масляная иммерсия, ВИ — водная иммерсия). Предельная разрешающая способность иммерсионного микроскопа не превышает 0,2 мкм. Ход лучей в иммерсионной системе показан на рис. 1.2.
Общее увеличение микроскопа определяется произведением увеличения объектива на увеличение окуляра. Например, увеличение микроскопа с иммерсионным объективом 90 и окуляром 10 составляет: 90 x 10 = 900.
Микроскопия в проходящем свете (светлопольная микроскопия) используется для изучения окрашенных объектов в фиксированных препаратах.
Темнопольная микроскопия. Применяется для прижизненного изучения микробов в нативных неокрашенных препаратах. Микроскопия в темном поле зрения основана на явлении дифракции света при боковом освещении частиц, взвешенных в жидкости (эффект Тиндаля). Эффект достигается с помощью параболоид- или кардиоид-конденсора, которые заменяют обычный конденсор в биологическом микроскопе (рис. 1.3). При этом способе освещения в объектив попадают только лучи, отраженные от поверхности объекта. В результате на темном фоне (неосвещенном поле зрения) видны ярко светящиеся частицы. Препарат в этом случае имеет вид, показанный на рис. 1.4, б (на вклейке).
Фазово-контрастная микроскопия. Предназначена для изучения нативных препаратов. Фазово-контрастное приспособление дает возможность увидеть в микроскоп прозрачные объекты. Свет проходит через различные биологические структуры с разной скоростью, которая зависит от оптической плотности объекта. В результате возникает изменение фазы световой волны, не воспринимаемое глазом. Фазовое устройство, включающее особые конденсор и объектив, обеспечивает преобразование изменений фазы световой волны в видимые изменения амплитуды. Таким образом достигается усиление различия в оптической плотности объектов. Они приобретают высокую контрастность, которая может быть позитивной или негативной. Позитивным фазовым контрастом называют темное изображение объекта в светлом поле зрения, негативным — светлое изображение объекта на темном фоне (см. рис. 1.4; на вклейке).
Для фазово-контрастной микроскопии используют обычный микроскоп и дополнительное фазово-контрастное устройство КФ-1 или КФ-4 (рис. 1.5), а также специальные осветители.
Люминесцентная (или флюоресцентная) микроскопия. Основана на явлении фотолюминесценции.
Люминесценция — свечение веществ, возникающее под воздействием внешнего излучения: светового, ультрафиолетового, ионизирующего и др. Фотолюминесценция — люминесценция объекта под влиянием света. Если освещать люминес-цирующий объект синим светом, то он испускает лучи красного, оранжевого, желтого или зеленого цвета. В результате возникает цветное изображение объекта.
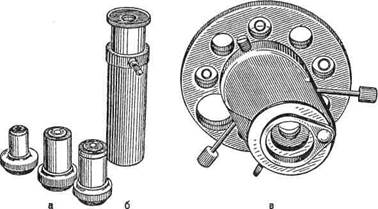
Рис. 1.5. Фазово-контрастное устройство, а — фазовые объективы; б — вспомогательный микроскоп; в — фазовый конденсор.
Длина волны излучаемого света (цвет люминесценции) зависит от физико-химической структуры люминесцирующего вещества.
Первичная люминесценция биологических объектов (собственная, или биолюминесценция) наблюдается без предварительного окрашивания за счет наличия собственных люминес-цирующих веществ, вторичная (наведенная) — возникает в результате окрашивания препаратов специальными люминесци-рующими красителями — флюорохромами (акридиновый оранжевый, ауромин, корифосфин и др.). Люминесцентная микроскопия по сравнению с обычными методами обладает рядом преимуществ: возможностью исследовать живые микробы и обнаруживать их в исследуемом материале в небольших концентрациях вследствие высокой степени контрастности.
В лабораторной практике люминесцентную микроскопию широко применяют для выявления и изучения многих микробов.
Электронная микроскопия. Позволяет наблюдать объекты, размеры которых лежат за пределами разрешающей способности светового микроскопа (0,2 мкм). Электронный микроскоп применяют для изучения вирусов, тонкого строения различных микроорганизмов, макромолекулярных структур и других субмикроскопических объектов. Световые лучи в таких микроскопах заменяет поток электронов, имеющий при определенных ускорениях длину волны около 0,005 нм, т.е. почти в 100 000 раз меньше длины волны видимого света. Высокая разрешающая способность электронного микроскопа, достигающая 0,1-0,2 нм, позволяет получить общее полезное увеличение до 1 000 000.
Наряду с приборами "просвечивающего" типа используют сканирующие электронные микроскопы, обеспечивающие рельефное изображение поверхности объекта. Разрешающая способность этих приборов значительно ниже, чем у электронных микроскопов "просвечивающего" типа.
Правила работы с микроскопом
Работа с любым световым микроскопом включает установку правильного освещения поля зрения и препарата и его микроскопию различными объективами. Освещение может быть естественным (дневным) или искусственным, для чего используют специальные источники света — осветители разных марок.
При микроскопии препаратов с иммерсионным объективом следует строго придерживаться определенного порядка:
1) на приготовленный на предметном стекле и окрашенный мазок нанести каплю иммерсионного масла и поместить его на предметный столик, укрепив зажимами;
2) повернуть револьвер до отметки иммерсионного объектива 90х или 10Ох;
3) осторожно опустить тубус микроскопа до погружения объектива в каплю масла;
4) установить ориентировочный фокус при помощи макрометрического винта;
5) провести окончательную фокусировку препарата микро метрическим винтом, вращая его в пределах только одного оборота. Нельзя допускать соприкосновения объектива с пре
паратом, так как это может повлечь поломку покровного стекла или фронтальной линзы объектива (свободное расстояние иммерсионного объектива 0,1—1 мм).
По окончании работы микроскопа необходимо удалить масло с иммерсионного объектива и перевести револьвер на малый объектив 8х.
Для темнопольной и фазово-контрастной микроскопии используют нативные препараты ("раздавленная" капля и др., см. тему 2.1); микроскопируют с объективом 40х или специальным иммерсионным объективом с ирис-диафрагмой, позволяющей регулировать численную апертуру от 1,25 до 0,85. Толщина предметных стекол не должна превышать 1 — 1,5 мм, покровных — 0,15—0,2 мм.
| Глава 2 |
 2015-05-30
2015-05-30 78702
78702








