Различают электроды 1, П, Ш рода и окислительно-восстановительные. Электроды 1 рода - металлические или газовые электроды, погруженные в раствор своих ионов и обратимые относительно этих ионов. Это основной тип электродов.
Пример
Ag=Ag++e; Е = Е° + 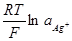 ;
;
Н++ е = 1/2Н2; Е = Е° + 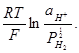
Электроды П рода - металлические электроды, покрытые труднорастворимой солью, опущенные в раствор хорошо растворимой соли, имеющей общий анион с малорастворимой солью.
Пример.
Hg|Hg2Cl2, KCl, Н2О||
Е = Е° 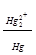 +
+ 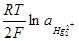
Поскольку Lp 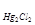 = a
= a 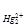 × a2Cl-,
× a2Cl-,
отсюда а 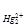 = Lp
= Lp 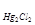 / a2Cl-
/ a2Cl-
Е = Еo 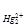 /Hg +
/Hg + 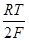 In Lp
In Lp 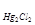 -
- 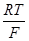 In a Cl- = Е* -
In a Cl- = Е* - 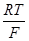 In a Cl-,
In a Cl-,
где Lр - произведение растворимости Hg2Cl2.
При 25°С Е = 0,2678 - 0,059 In a Cl-,
При 0,1 н КС1, Е = 0,3366 В,
1,0 н КС1, Е = 0,2828 В,
н.р КС1, Е = 0,2438 В.
Аналогично работают электроды:
хлорно-серебряный Ag|AgCl, КС1, Н2О||; E=E*-(RT/F) Ina Cl-,
ртутно-сульфатный Hg|Hg2SО4,K2SО4, Н2О|| E=Е*-(RT/2F)ln a 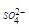
ртутно-оксидный He|HgO, КОН, Н2О|| E=Е*-(RT/F) In аон-.
Таким образом, электроды П рода - это металлические электроды, реагирующие на изменение активности (концентрации) анионов.
Электроды Ш рода (Глэстона) - металлические электроды, реагирующие на изменение концентрации чужеродных катионов. Эти электроды интересны, но довольно редки. Представляют собой металл, погруженный в раствор труднорастворимой соли при наличии малорастворимой с тем же анионом, и хорошо растворимой соли, имеющей общий катион с малорастворимой солью.
|
|
|
Пример.
Pb |РbС2О4, СаС2О4, CaCl2, Н2О||
т/р м/р х/р
Е = Е° Pb2+/Pb + 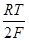 In aPb2+;
In aPb2+;
aPb2+ = LpPb 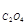 C204/a
C204/a 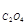 2-; а
2-; а 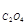 = LpСа
= LpСа 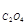 /аСа2+;
/аСа2+;
Е = Еo Pb2+/Pb + 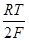 In L Pb
In L Pb 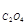 /L Сa
/L Сa 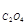 +
+ 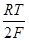 In аCa2+=E*+
In аCa2+=E*+ 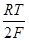 lnaCa2+ .
lnaCa2+ .
Потенциал свинцового электрода реагирует на концентрацию катионов
кальция.
Окислительно-восстановительные электроды - индиферентные (не взаимодействующие с электролитом) электроды, погруженные в электролит, содержащий ионы какого-нибудь сорта в двух степенях окисления Ох и Red, между которыми существует равновесие:
Ox + ne = Red
Е = Е°ox/Red + 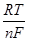 In (aox/aRed).
In (aox/aRed).
Правило Лютера устанавливает взаимосвязь окислительно-восстановительных потенциалов.
Выводится из 3-го начала термодинамики: если переход из одного состояния в другое происходит изотермически и обратимо, то изменение энергии Гиббса не зависит от пути перехода, а определяется только начальным и конечным состояниями:

Fe3+ +3е ® Fe DG3-0 =DG 3-2+DG 2-0
-3F Еo 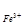 /
/ 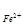 =-F Еo
=-F Еo 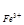 /
/ 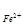
Fe3++e ® Fe2+ +2e®Fe - 2F Еo 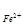 /Fe,
/Fe,
3Eо 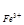 /Fe = Еo
/Fe = Еo 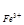 /
/ 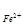 +2Еo
+2Еo 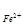 /Fe.
/Fe.
Правило Лютера имеет большое значение. Так, ЕoFe3+/Fe нельзя измерить, поскольку Fe восстанавливает практически весь Fe3+ до Fe2+. Зато, зная ЕoFe2+/Fe и ЕoFe3+/Fe2+, легко рассчитать ЕoFe3+/Fe по правилу Лютера.
 2015-05-22
2015-05-22 608
608








