Из всего многообразия катодных процессов можно выделить:
1) гомогенные окислительно-восстановительные процессы, 2) процессы с газовыделением, 3) процессы с выделением твердой фазы, 4) процессы с выделением жидкой фазы, 5) совместный разряд ионов.
Примером гомогенного окислительно-восстановительного катодного процесса является, например, реакция восстановления ионов трехвалентного железа до двухвалентного состояния:
Fe3+ + e = Fe2+
Процесс не связан с образованием новой фазы, поэтому он не сопровождается фазовой поляризацией. Для простых ионов, как правило, невелики и затруднения в акте разряда-ионизации. И определяющую роль играет концентрационная поляризация, обусловленная замедленной доставкой Fe3+ к поверхности катода и замедленным отводом ионов Fe2+ в объем электролита. При этом в катодном процессе будет наблюдаться предельный ток, соответствующий условию ax,s = 0, а в анодном процессе - предельный анодный ток, когда aRed,s=0. Изменение активностей окисленной и восстановленной форм с расстоянием от поверхности электрода показано на рис.3.4, а вид поляризационной кривой окислительно-восстановительной реакции при замедленной диффузии приведен на рис.3.5.
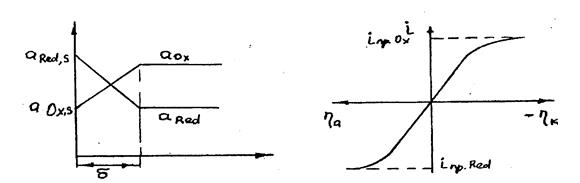
Рис.3.4.Изменение активностей Рис.3.5. Вид поляризационной
окисленной и восстановленной кривой окислительно-восстано-
форм с расстоянием от вительной реакции при
поверхности электрода замедленной диффузии
При этом величина поляризации будет связана с величиной плотности тока уравнением:
h= 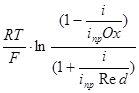 . (3.19)
. (3.19)
Процессы с газовыделением на катоде имеют место при получении Н2, электролитическом разложении воды, получении водорода и хлора, электролизе растворов хлористого натрия. Процесс выделения водорода часто играет роль побочного процесса при выделении металлов электролизом водных растворов, поэтому исследованию закономерностей разряда ионов водорода уделено много внимания. Именно для этого процесса первоначально была разработана теория замедленного разряда, или теория электрохимической поляризации.
Для перенапряжения выделения водорода из водных растворов практически на всех металлах справедливо уравнение Тафеля в широком интервале плотностей тока (от 10-15 до 10° А/см2):
h = а + blgi.
Коэффициент b для большинства металлов находится в пределах 0,10-0,13, что отвечает коэффициентам переноса, близким к 0,5. Коэффициент а, равный перенапряжению при i= 1 А/см2, изменяется в широких пределах, что определяется строением ДЭС, величинами тока обмена.
Самыми высокими перенапряжениями сопровождается выделение водорода на ртути, свинце, таллии, кадмии, цинке, олове. Значения коэффициента а для этих металлов находятся в пределах 1,55-1,22 В, что отвечает токам обмена 10-13 – 10-11 А/см2.
Средними значениями перенапряжения сопровождается выделение водорода на висмуте, титане, меди, железе, серебре, золоте, кобальте. Этим катодам отвечают величины токов обмена 10-10–10-6А/см2, коэффициентов а (1,05-0,52) В.
Низкие перенапряжения (а=0,41-0,23) сопровождают выделение водорода на Re,Pd, Rh, Pt, для которых характерны и самые высокие токи обмена (10-4 –10-3 А/см2). Для этих же металлов характерны низкие значения коэффициентов b (0,03).
Для этой группы металлов предполагается иной механизм возникновения перенапряжения, а именно замедленная рекомбинация атомов водорода в молекулы, т. е. наблюдаемая поляризация является фазовой.
Все другие экспериментальные зависимости перенапряжений, в том числе и влияние ПАВ, количественно объясняются с позиций теории замедленного разряда, изменением скачка потенциала в плотной части двойного электрического слоя. Процессы с газовыделением существенно увеличивают энергозатраты, во-первых, за счет большого перенапряжения при прохождении электродных реакций, а также из-за снижения электропроводности электролита в связи с наполнением его непроводящим ток газом. Это необходимо учитывать при проектировании электролизеров и в расчетах их энергетического баланса.
Процессы с выделением твердой фазы широко распространены при получении и рафинировании металлов, получении гальванических покрытий, фольги, монокристаллов. В этих процессах важную роль могут играть все виды поляризации: электрохимическая, концентрационная и фазовая. На структуру и свойства катодного осадка исключительное влияние оказывает фазовая поляризация.
При осаждении металла на инородную поликристаллическую основу вначале происходит образование трехмерных зародышей, которые концентрируются в местах выхода дефектов кристаллической решетки.
При осаждении на основу из того же металла, как правило образуются двухмерные зародыши. Иногда они распространяются на все зерно, повторяя его структуру. Это явление называется эпитаксиальным ростом.
Следующий этап - слияние зародышей с образованием поликристаллического осадка. Его структура зависит от многих факторов: природы осаждаемого металла, плотности тока, состава электролита, режима и условий электролиза и т.д. Г.Фишер предложил различать четыре типа кристаллических осадков:
1. Изолированные кристаллы, ориентированные в направлении поля (дендриды и порошки).
2. Кристаллы, ориентированные к основе и воспроизводящие ее структуру (грубокристаллические осадки).
3. Текстурированные компактные осадки, ориентированные в направлении поля (тонкодисперсные столбчатые осадки).
4. Неориентированные мелкодисперсные осадки, состоящие из беспорядочно ориентированных мелкодисперсных зерен.
Отнесение к определенному типу можно осуществить на основе микроскопического исследования поперечных шлифов.
В реально протекающих электрохимических процессах часть тока электролиза (I) идет на образование зародышей (Iз), а вторая часть(Iр) участвует в росте кристаллов. Если Iз >Iр, то на катоде образуется мелкокристаллический осадок, если Iр> Iз - получается крупнокристаллический осадок.
Важную роль на качество катодного осадка оказывает поляризация, обусловленная различными причинами: малыми токами обмена, концентрационной поляризацией и т.д.
На рис.3.6 приведена полученная А.Г.Самарцевым зависимость числа кристаллов (Z) на катоде площадью 0,53 см2 при электролизе раствора AgNO3 от тока и концентрации AgNO3: 1-0,001Н; 2-0,01Н; 3-0,1Н; 4-2,ОН. Видно, что число образующихся зародышей тем больше, чем выше плотность тока и ниже концентрация AgNO3, т. е. больше поляризация электрода.
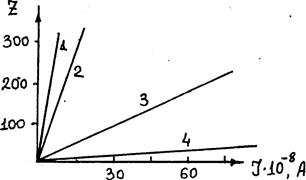
Рис.3.6. Зависимость числа кристаллов на катоде от тока и
концентрации AgNO3
Отнесение к типам осадка по Фишеру, по существу зависит от величины поляризации. К первой группе металлов относятся Аg, Tl, Pb, Cd, Sn, Hg. Токи обмена для этих металлов велики (10-1 - 10-3 А/см2), поэтому они выделяются с малым перенапряжением, отвечающим области единичного зародыше-образования и крупным зародышам (в соответствии с уравнением (2.48)).
Эти металлы образуют на электроде изолированные либо губчатые кристаллы, ориентированные по линиям тока.
Вторую группу металлов составляют Bi, Cu, Zn, Au, Ag, Sb. Токи обмена здесь меньше, имеют порядок 10-5 А/см2, что обусловливает большую поляризацию электродов, увеличение доли тока, идущего на образование зародышей. При этом образуются более мелкокристаллические осадки, ориентированные к основе.
Наибольшей величиной перенапряжения обладают металлы группы железа (Fe, Ni,Co). Токи обмена у них очень малы (10-8-10-9 А/см2). При большой поляризации создаются благоприятные условия для возникновения новых центров кристаллизации, образуются мелкокристаллические осадки столбчатой структуры, ориентированные в направлении поля.
Наиболее качественные плотные, тонкодисперсные, неориентированные осадки получают при электролизе путем введения в электролит поверхностно активных веществ (ПАВ). ПАВ, адсорбируясь на поверхности катода, снижают токи обмена, увеличивают поляризацию, что способствует измельчению осадка. Кроме того, адсорбированные ПАВ затрудняют поверхностную диффузию адсорбированных атомов, что препятствует созданию ориентированной структуры.
Подбор ПАВ остается эмпирическим. Его адсорбируемость или поверхностная активность, согласно А.К.Лоренцу, является функцией заряда частиц, молекулярной массы ПАВ, поляризуемости и молярной рефракции.
При осаждении Ag, Сu, Cd, Pb, Sn из кислых электролитов поверхность металла заряжена положительно. На такой поверхности лучше сорбируются анионы и лучшие результаты дает применение ПАВ анионного класса, например сульфокислот.
Для цинка, поверхность которого в кислых электролитах заряжена отрицательно, более эффективны ПАВ катионного класса, например хлориды, сульфаты тэтрабутиламония.
Для металлов, потенциал выделения которых близок к потенциалу нулевого заряда, оказывают благоприятное влияние ПАВ нейтрального типа.
В общем случае, чем больше влияние на поляризацию оказывает органическое соединение, тем более мелкокристаллическим и блестящим оказывается осадок. Благоприятствует этому и лучшая смачиваемость электрода электролитом (В.С Колеватова).
Вместе с тем сорбирующиеся вещества частично остаются в осадке и могут привести к загрязнению его элементами, из которых состоит ПАВ. Это необходимо учитывать при получении электролизом особо чистых металлов.
Жидкие катоды (ртутный) находят широкое применение как в аналитической химии (полярография), так и в технологии получения чистых и сверхчистых металлов (амальгамная металлургия).
В соответствии с уравнением Нернста потенциал амальгамы
Е Me(Hg) = Е° Меn+/Ме + 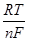 ln aMеn+/а Me(Hg) (3.20)
ln aMеn+/а Me(Hg) (3.20)
отличается от равновесного потенциала металла Me
Еме= Eo Меn+/Ме + 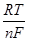 ln aMеn+ (3.21)
ln aMеn+ (3.21)
на величинуDЕ = - 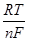 lnaMe(Hg) получившую название "деполяризации", поскольку при aMe(Hg)<1 DE - положительно.
lnaMe(Hg) получившую название "деполяризации", поскольку при aMe(Hg)<1 DE - положительно.
Большая величина перенапряжения выделения водорода на ртути
-h = 1,45 + 0,1131gi (3.22)
и большая величина деполяризации (DE) для электроотрицательных металлов позволяют успешно выделять на ртути даже щелочные металлы (промышленный метод получения чистой щелочи).
Изменение концентраций с расстоянием от поверхности электрода при разряде ионов металла на амальгаме показано на рис.3.7.
с, х
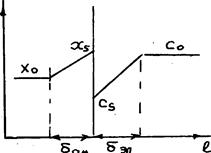
Рис.3.7. Характер изменения концетраций в электролите и в жидком металле на амальгамном электроде: xо и cо - концентрации металла и его ионов в объемах амальгамы и электролита; xs и cs - концентрации металла и его ионов на поверхности раздела амальгама -электролит; dам и dэл - толщина диффузионного слоя в амальгаме и электролите.
Несмотря на то, что амальгамный электрод поляризуется в большей степени, чем твердые электроды из-за наличия двойной концентрационной поляризации:
со стороны электролита h = 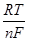 ln
ln 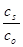 , (3.23)
, (3.23)
со стороны сплава h= 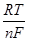 ln
ln 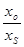 , (3.24) он успешно применяется для получения чистых и сверхчистых металлов.
, (3.24) он успешно применяется для получения чистых и сверхчистых металлов.
 2015-05-22
2015-05-22 1315
1315








