У больных с печёночной энцефалопатией часто развивается алкалоз. Это может быть связано с токсической стимуляцией дыхательного центра аммиаком, с введением щелочных соединений, например цитрата при переливании крови, с введением калия или с гипокалиемией.
При синтезе мочевины расходуется бикарбонат. Снижение активности цикла мочевины ведет к повышению уровня бикарбоната в плазме, развитию метаболического алкалоза, возрастанию экскреции аммиака почками [26].
Гипоксия увеличивает чувствительность головного мозга к аммиаку. Стимуляция дыхательного центра ведёт к увеличению глубины и частоты дыхания, в результате развиваются гипокапния и снижение церебрального кровотока. Увеличение содержания в крови органических кислот (лактата и пирувата) коррелирует со снижением рСО2.
Любые сильнодействующие диуретики могут ускорить развитие печёночной комы. Это может быть связано с гипокалиемией [16] и алкалоза, способствующего прохождению ионов аммиака через гематоэнцефалический барьер. Помимо гипокалиемии, другие электролитные нарушения или усиленный диурез также может стимулировать развитие энцефалопатии.
|
|
|
Имеется сходство между нейроинтоксикацией марганцем и печёночной энцефалопатией. У больных циррозом печени с энцефалопатией уровень марганца в крови и головном мозге повышен; кроме того, у них выявляется усиление сигнала от бледного шара при МРТ [30]. Такие же изменения при МРТ выявляются, однако, и у больных циррозом печени без энцефалопатии [71], поэтому связь между уровнем марганца и печёночной энцефалопатией остаётся недоказанной.
НАРУШЕНИЕ ОБМЕНА УГЛЕВОДОВ
В опытах на собаках гепатэктомия приводила к смерти от гипогликемической комы. У больных с хроническими заболеваниями печени редко наблюдаются гипогликемические состояния, однако они могут осложнить течение фульминантною гепатита (см. главу 8).
a-Кетоглугаровая и молочная кислоты поступают из периферических тканей в метаболический пул печени. При неврологических нарушениях содержание этих кислот в крови возрастает, что свидетельствует о тяжести поражения печени. Снижение содержания в крови кетоновых тел также отражает выраженность нарушений печёночных функций. По мере усугубления печёночной недостаточности наблюдается прогрессирующее нарушение обмена углеводов.
Заключение
Единого механизма, объясняющего развитие печёночной энцефалопатии, не существует. Мозг контролирует наше поведение при помощи многочисленных тормозных и возбуждающих проводящих путей. Хотя нейромедиаторы образуются в самом мозге, они зависят от поступающих издалека влияний и субстратов (рис. 7-10). При печёночной недостаточности или при наличии порто-системных шунтов возникает сложный комплекс нарушений, влияющих на многочисленные нейромедиаторные системы.
|
|
|
Из всех описанных выше нарушений действие аммиака является ведущим в патогенезе печёночной энцефалопатии, в то время как нарушения глутаминовой, серотониновой нейропередачи, а также нейропередачи, связанной с эндогенными бензодиазепинами, требуют дальнейшего изучения. Роль ложных нейромедиаторов и ГАМ К представляется менее убедительной, чем предполагалось вначале.
Метаболические процессы в головном мозге при заболеваниях печени, без сомнения, нарушены. Вероятно, это следствие, а не причина изменений, наблюдаемых в нейромедиаторных системах. При хронических заболеваниях печени выявляются подлинно структурные изменения в головном мозге, сопровождающиеся нарушенным функционированием нейротрансмиттерных систем. Такой мозг становится чрезмерно чувствительным к воздействию вредных факторов: опиатов, электролитных нарушений, сепсиса, артериальной.гипотензии, гипоксии, что не отмечается в норме.
Лечение печёночной энцефалопатии [41]
Лечение печёночной энцефалопатии (табл. 7-5) можно разделить на три основных пункта:
1. Установление и устранение факторов, способствующих развитию печёночной энцефалопатии.
2. Меры, направленные на снижение образования и абсорбции аммиака и других токсинов, образующихся в толстой кишке. Они включают уменьшение количества и модификацию пищевых белков, изменение кишечной микрофлоры и внутрикишечной
Таблица 7-5. Лечение печёночной прекомы и комы
Острая печёночная энцефалопатия:
1. Выявляют факторы, способствующие развитию энцефалопатии.
2. Очищают кишечник от азотсодержащих веществ: а) останавливают кровотечение б) делают фосфатную клизму
3. Назначают безбслковую диету и по мере выздоровления медленно повышают содержание белка в пище
4. Назначают лактулозу или лактитол
5. Назначают неомицин внутрь по 1г 4 раза в сутки в течение 1 нед
6. Поддерживают калорийность пищи, количество жидкости и электролитный баланс
7. Отменяют диуретики, контролируют уровень электролитов в сыворотке крови
Хроническая печёночная энцефалопатия:
1. Избегают применения азотсодержащих лекарств
2. Ограничивают содержание белка в пище в пределах переносимого — около 50 г в сутки, рекомендуя потреблять в основном растительные белки
3. Обеспечивают опорожнение кишечника по меньшей мере 2 раза в день
4. Назначают лактулозу или лактитол
5. При ухудшении состояния переходят на лечение, применяемое при острой энцефалопатии
среды (антибиотики, лактулоза или лактитол), стимуляцию опорожнения толстой кишки (клизмы, лактулоза или лактитол).
3. Назначение препаратов, модифицирующих соотношение нейромедиаторов прямым (бромокриптин, флумаземил) или непрямым (аминокислоты с разветвлённой цепью) путём. В настоящее время в клинической практике эти методы применяются мало.
Выбор метода лечения зависит от клинической картины: субклинической, острой или персистирующей хронической энцефалопатии.
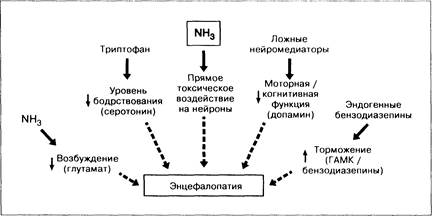
Рис. 7-10. Многофакторный механизм развития печёночной энцефалопатии. Нарушение нейромедиаторных систем приводит к тому, что головной мозг становится более чувствительным к другим повреждающим факторам, включая наркотики, сепсис, гипоксию и артериальную гипотензию.
ДИЕТА
При острой печёночной энцефалопатии количество пищевых белков необходимо уменьшить до 20 г в сутки. Калорийность пищи поддерживают на уровне 2000 ккал в сутки или выше при приёме внутрь или парентеральном питании.
Во время выздоровления содержание белка увеличивают на 10 г через день. При возникновении рецидива энцефалопатии возвращаются к предыдущему уровню белка в пище. У больных, выздоравливающих после острого эпизода комы, содержание белка в пище вскоре доводят до нормы. При хронической энцефалопатии больным необходимо постоянно ограничивать количество пищевых белков во избежание развития психопатологических симптомов [68]. Обычное содержание белка в пище составляет 40—60 г в сутки.
|
|
|
Растительные белки переносятся лучше, чем животные [72]. У них меньший аммониегенный эффект и они содержат мало метионина и ароматических аминокислот. Кроме того, растительные белки оказывают более выраженное слабительное действие, при их применении увеличивается поступление пищевых волокон; это ведёт к усилению связывания и выведения азота, содержащегося в бактериях толстой кишки [77]. Приём растительной пищи может быть затруднен из-за развития метеоризма, диареи и вздутия живота.
В острых случаях можно полностью исключить из пищи белки на срок от нескольких дней до нескольких недель — это не принесёт вреда больному. Даже при хронической энцефалопатии у больных, у которых потребление пищевых белков ограничивалось в течение многих месяцев, редко встречаются клинические признаки белковой недостаточности. Ограничение белка показано только больным с признаками энцефалопатии. В остальных случаях при заболеваниях печени можно успешно назначать высокобелковую диету; это достигается одновременным применением лактулозы или лактитола.
АНТИБИОТИКИ
Назначаемый перорально неомицин успешно уменьшает образование азотистых соединений в кишечнике [20|. Несмотря на то что только небольшое количество этого препарата всасывается из кишечника, его можно обнаружить в крови больных, поэтому длительное применение неомицина может привести к снижению слуха или глухоте. Его следует назначать только в острых случаях по 4—6 г/сут в несколько приёмов в течение 5—7 дней. При этом улучшение клинического состояния больных сложно связать с изменением фекальной микрофлоры |20|.
|
|
|
Метронидазол в дозе 200 мг 4 раза в сутки внутрь, по-видимому, действует так же эффективно, как и неомицин [40]. Его не следует применять в течение длительного времени из-за дозозависимого токсического воздействия на ЦНС. При острой печёночной коме назначают лактулозу, а если её действие наступает медленно или оказывается неполным, добавляют неомицин. Эти два препарата являются синергистами [76], вероятно потому, что воздействуют на разные группы бактерий.
ЛАКТУЛОЗА (рис. 7-11) [8] И ЛАКТИТОЛ (табл. 7-6)
Слизистая оболочка кишечника человека не содержит ферменты, расщепляющие эти синтетические дисахариды. Принимаемая перорально, лактулоза достигает слепой кишки, в которой она расщепляется бактериями с образованием преимущественно молочной кислоты; рН каловых масс понижается. Это способствует росту бактерий, расщепляющих лактозу; при этом рост аммониегенных микроорганизмов, таких как бактероиды, подавляется. Лактулоза может «детоксицировать» жирные кислоты с короткой цепью, образующиеся при наличии крови и белков. В присутствии лактулозы и крови бактерии толстой кишки в основном расщепляют лактулозу [47]. Это имеет особое значение при печёночной энцефалопатии, вызванной кровотечением. При применении лактулозы осмотическое давление в толстой кишке повышается.
Механизм действия этого препарата точно не известен. Кислая реакция каловых масс может уменьшить ионизацию и, следовательно, абсорбцию аммиака, а также аминов и других токсичных азотсодержащих соединений; при этом содержание аммиака в кале не возрастает. В толстой кишке лактулоза более чем в 2 раза увеличивает образование бактерий и растворимых соединений азота [77]. В результате азот не абсорбируется в виде аммиака и уменьшается образование мочевины [77].
При назначении лактулозы нужно стремиться к образованию у больного кислого кала без диареи. Препарат назначают в дозе 10—30 мл 3 раза в сутки, что приводит к двукратной дефекации полужидким калом.
Таблица 7-6. Эффективность лактитола по сравнению с лактулозой
Сходное действие в толстой кишке
Столь же эффективен при печёночной энцефалопатии
Действует более быстро
Более удобен в употреблении (порошкообразный)
Менее сладкий
В меньшей степени вызывает диарею и метеоризм
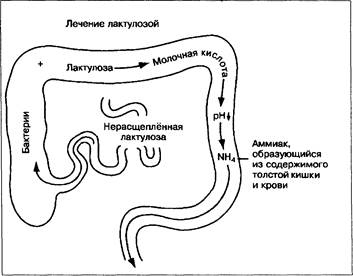
Рис. 7-11. Лактулоза достигает толстой кишки в неизменённом виде. Там под влиянием бактерий она расщепляется с образованием органических кислот, в результате формируется кислый кал. Этот процесс вызывает ионизацию аммиака в толстой кишке и снижение его всасывания.
Побочные эффекты включают в себя метеоризм, диарею и боли в кишечнике. Диарея может быть настолько сильной, что уровень натрия в сыворотке крови превышает 145 ммоль/л, уровень калия снижается и развивается алкалоз. Объём циркулирующей крови уменьшается, в результате чего нарушается функция почек. Такие осложнения развиваются особенно часто, если суточная доза препарата превышает 100 мл. Некоторые побочные эффекты могут быть связаны с примесью в сиропе лактулозы других Сахаров. Кристаллическая лактулоза может оказаться менее токсичной.
Лактитол (бета-галактозидсорбитол) представляет собой второе поколение дисахаридов. Его легко получать в химически чистой кристаллической форме, из которой можно приготовить порошок. Этот препарат не инактивируется и не абсорбируется в тонкой кишке, но расщепляется бактериями толстой кишки [53]. Порошкообразный лактитол более удобен в употреблении, чем жидкая лактулоза, и может быть использован как сахарозаменитель. Он приятнее на вкус и менее приторный. Суточная доза составляет приблизительно 30 г.
Лактитол так же эффективен при лечении хронической [44] и острой портосистемной энцефалопатии, как и лактулоза. Лактитол действует быстрее лактулозы и в меньшей степени вызывает диарею и метеоризм [10, 44].
Лактулозу и лактитол используют для лечения субклинической формы печёночной энцефалопатии [46]. При их применении улучшаются результаты психометрических тестов. В дозе 0,3—0,5 г/кг в сутки лактитол хорошо переносится больными и достаточно эффективен [61].
Очищение кишечника при помощи слабительных средств. Печёночная энцефалопатия развивается на фоне запоров, а ремиссии связаны с возобновлением нормального действия кишечника. Поэтому у больных с печёночной энцефалопатией необходимо обратить особое внимание на роль клизм и очищения кишечника сульфатом магния. Можно применять клизмы с лактулозой и лактозой, а после них — с чистой водой [73]. Все клизмы должны быть нейтральными или кислыми, чтобы понизить абсорбцию аммиака. Клизмы с сульфатом магния могут привести к опасной для больного гипермагниемии [15]. Фосфатные клизмы безопасны.
ДРУГИЕ ФАКТОРЫ, СПОСОБСТВУЮЩИЕ РАЗВИТИЮ ЭНЦЕФАЛОПАТИИ
Больные с печёночной энцефалопатией крайне чувствительны к седативным препаратам, поэтому по возможности следует избегать их применения. Если у больного предполагают передозировку таких препаратов, то необходимо ввести соответствующий антагонист. Если больного невозможно удержать в постели и необходимо его успокоить, назначают небольшие дозы темазепама или оксазепама. Морфин и паральдегид абсолютно противопоказаны. Хлордиазепоксид и геминеврин рекомендуют пациентам, страдающим алкоголизмом с надвигающейся печёночной комой. Больным с энцефалопатией противопоказаны препараты, о которых известно, что они могут вызвать печёночную кому (например, аминокислоты и диуретики для применения внутрь).
Недостаток калия можно восполнить фруктовыми соками, а также шипучим или медленно растворимым хлоридом калия. При неотложной терапии хлорид калия можно добавить в растворы для внутривенного введения.
ЛЕВОДОФА И БРОМОКРИНТИН
Если портосистемная энцефалопатия связана с нарушением в дофаминергических структурах, то восполнение запасов дофамина в головном мозге должно улучшить состояние больных. Дофамин не проходит через гематоэнцефалический барьер, но это может сделать его предшественник — леводофа. При острой печёночной энцефалопатии этот препарат может оказать временное активирующее действие [37], однако он эффективен только у небольшого числа больных.
Бромокриптин представляет собой специфический агонист дофаминовых рецепторов с пролонгированным действием. Назначаемый в дополнение к малобелковой диете и лактулозе, он приводит к улучшению клинического состояния, а также психометрических и электроэнцефалографических данных у больных с хронической портосистемной энцефалопатией [42]. Бромокриптин может оказаться ценным препаратом для отдельных больных с плохо поддающейся лечению хронической портальной энцефалопатией, резистентной к ограничению белка в диете и лактулозе, развившейся на фоне устойчивой компенсации функции печени.
ФЛУМАЗЕНИЛ
Этот препарат является антагонистом бензодиазепиновых рецепторов и вызывает временное, неустойчивое, но отчётливое улучшение состояния приблизительно у 70 % больных с печёночной энцефалопатией, связанной с ФПН или циррозом печени [4, 25]. Рандомизированные исследования подтвердили этот эффект и показали, что флумазенил может препятствовать действию лигандов, агонистов бензодиазепиновых рецепторов, которые образуются in situ в головном мозге при печёночной недостаточности [57]. Роль этой группы препаратов в клинической практике в настоящее время изучается.
АМИНОКИСЛОТЫ С РАЗВЕТВЛЁННОЙ ЦЕПЬЮ
Развитие печёночной энцефалопатии сопровождается изменением соотношения между аминокислотами с разветвлённой цепью и ароматическими аминокислотами. Для лечения острой и хронической печёночной энцефалопатии применяются инфузии растворов, содержащих большую концентрацию аминокислот с разветвлённой цепью. Полученные результаты крайне противоречивы. Это, вероятно, связано с использованием в подобных исследованиях различных типов аминокислотных растворов, разных путей их введения и различиями в группах больных. Анализ контролированных исследований не позволяет однозначно говорить об эффективности внутривенного введения аминокислот с разветвлённой цепью при печёночной энцефалопатии [43].
Принимая во внимание высокую стоимость аминокислотных растворов для внутривенного введения, трудно оправдать их использование при печёночной энцефалопатии в тех случаях, когда уровень аминокислот с разветвлённой цепью в крови высок.
Несмотря на отдельные исследования, показывающие, что аминокислоты с разветвлённой цепью, назначаемые внутрь, с успехом применяются при печёночной энцефалопатии [56], эффективность этого дорогостоящего метода остаётся спорной [21, 41].
ОККЛЮЗИЯ ШУНТОВ
Хирургическое устранение портокавального шунта может привести к регрессу тяжелой портосистемной энцефалопатии, развившейся после его наложения. Для того чтобы избежать повторных кровотечений, перед выполнением этой операции можно прибегнуть к пересечению слизистой оболочки пищевода f9]. С другой стороны, шунт можно перекрыть при помощи рентгенохирургических методов с введением баллона [58] или стальной спирали [14]. Эги методы можно также применить для закрьпия спонтанных спленоренальных шунтов [28].
ПРИМЕНЕНИЕ ИСКУССТВЕННОЙ ПЕЧЕНИ
У больных циррозом печени, находящихся в коме, не прибегают к сложным методам лечения с применением искусственной печени. Эти больные либо находятся в терминальном состоянии, либо выходят из комы без этих методов. Лечение с помощью искусственной печени обсуждается в разделе, посвящённом острой печёночной недостаточности (см. главу 8).
ТРАНСПЛАНТАЦИЯ ПЕЧЕНИ
Этот метод может стать окончательным решением проблемы печёночной энцефалопатии. У одного больного, страдавшего энцефалопатией на протяжении 3 лет, в течение 9 мес после трансплантации наблюдалось заметное улучшение [51]. У другого больного с хронической гепатоцеребральной дегенерацией и спастической параплегией состояние значительно улучшилось после ортотопической пересадки печени [59] (см. главу 35).
 2015-06-10
2015-06-10 512
512








