Материальный баланс кристаллизации
Кристаллизация с удалением части растворителя. Обозначим:
G p, G кр, Gм — количества исходного раствора, полученных кристаллов и маточного раствора, кг;
Bp, bм — концентрации исходного и маточного растворов, вес. доли;
а = М/Мкр — отношение молекулярных весов абсолютно сухого растворенного вещества и кристаллосольвата (для водного раствора кристаллогидрата); при кристаллизации без присоединения молекул растворителя М = Мкр и а = 1;
W — количество удаленного растворителя, кг.
Тогда общий баланс будет:
G р = G кр + G м + W (XVI, 1)
Баланс по абсолютно сухому растворенному веществу:
G р b р = G кр a + Gм b м (XVI, 2)
Весовое количество полученных кристаллов определяется совместным решением уравнений (XVI, 1) и (XVI, 2). Обычно G p b p, b uи а известны; W вычисляют при помощи уравнения (IX, 9) по заданным Gp, b pи bM. Величина G кр составляет:
G ккр= 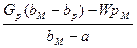 XVI, 3)
XVI, 3)
При а = 1 имеем
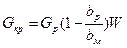 (XVI, 4)
(XVI, 4)
Кристаллизация без удаления растворителя (W =0). Количество полученных кристаллов
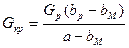 (XVI. 5)
(XVI. 5)
При а = 1 находим
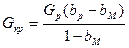 (XVI, 6)
(XVI, 6)
При испарении растворителя в газ (воздух) расход газа (в кг) определяется из уравнения
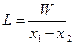 (XVI, 7)
(XVI, 7)
где L — расход сухого газа (воздуха), кг; х1 х 2 — начальное и конечное влагосодержание газа (воздуха), кг влаги/кг сухого газа
Тепловой баланс непрерывной кристаллизации
При растворении твердого кристаллического вещества происходит поглощение тепла qкp для разрушения кристаллической решетки (теплота плавления) и выделение тепла при химическом взаимодействии вещества с растворителем qp (образование гидратов). В зависимости от величин qкp и qp тепловой эффект кристаллизации будет положительным или отрицательным.
Помимо принятых в материальном балансе введем следующие обозначения: i р, i кр, i м — энтальпия раствора, кристаллов и маточного раствора, кдж/кг; i т 1 , i т 2 — начальная и конечная энтальпия теплоносителя, кдж/кг; i01, io2 — начальная и конечная энтальпия охлаждающей среды, кдж/кг; I — энтальпия парообразного растворителя, кдж/кг; r — теплота образования кристаллической решетки (теплота затвердевания), кдж/кг кристаллов; Δ q — тепловой эффект концентрирования раствора при изменении его концентрации от bр до bм кдж; G T, G 0 — количество теплоносителя или охлаждающей среды, кг/сек.
В общем случае будем иметь:
| Приход тепла | Расход тепла | ||
| С раствором | Gр iр = Q1 | С кристаллами | Gкр iкр = Q5 |
| Теплота кристаллизации | Gкр r = Q2 | С маточным раствором | G м i м = Q6 |
| Теплота дегидратации | ±Δ qGм bм = Q3 | С парами растворителя | WI = Q7 |
| Получено от теплоносителя | G т (i т1 – i т2 ) Q4 | С охлаждающим агентом Потери в окружающую среду | Go(i 02- i 01) = Q8 Q9 |
Тогда можно записать:
Q 1 + Q 2 + Q 3 + Q4 = Q5 + Q6 + Q6 + Q7 ± Q 9
При кристаллизации с охлаждением Q 4 = 0 и Q 7 = 0; при кристаллизации с испарением части растворителя Q8 == 0; при вакуум-кристаллизации Q 4 = 0 и Q8 = 0.
Для теплоносителя — насыщенного водяного пара (в кдж)
Q4 = D (ID –i конд)
где ID, i конд — энтальпии пара и конденсата, кдж/кг; D —расход пара, кг/сек.
Для охлаждающей среды — воздуха (в кдж/сек)
Q8=L(12 —I1)
где L — расход сухого воздуха, кг/сек; I1, 12 — его начальная и конечная энтальпии. кдж/ кг
В зависимости от температурных условий потери тепла Q9 могут быть положительны или отрицательны.
Энтальпии iр, i кр, i мрассчитывают (в кдж/кг) по уравнению общего вида
i = с(t 2 — t1)
в котором с — средняя теплоемкость, кдж/(кг-град); (t2 — tt) — перепад температур (конечной и начальной).
Напряженность поверхности по испаренной влаге в воздушных кристаллизаторах в среднем можно принять 0,042 кг/(м2ч). Расчет размеров поверхности охлаждения или нагревания производится по общим правилам расчета теплообменных поверхностей (см. главу VII). Более подробные расчеты процессов кристаллизации из растворов приведены в специальной литературе*.
-----------------------------
* См., например: Л. Н М а т у с е в и ч, Кристаллизация из растворов в химической промышленности, Изд. «Химия», 1968
 2015-06-10
2015-06-10 2202
2202








