При равенстве концентраций [H+] и [ OH- ] в нейтральной среде [H+] = [ OH- ] = 10–7
В кислой среде концентрация концентрация [H+] больше, чем 10–7 моль/л, а в щелочной среде –– меньше, чем 10–7. Кислотность среды выражается величиной водородного показателя рН, рассчитанной по формуле:
рН = – lg[H+]
10-1… 10-5 10-6 10-7 10-8 10-9… 10-14
кислая ← [H+] → щелочная
нейтральная
1 2 3 4 5 6 7 8 9 10 11 12 13 14
pH
Щелочность среды выражается величиной рОН, значение которой рассчитывается по формуле рОН = – lg[ОH–]. В кислой среде рН< 7, рОН>7, в щелочной среде рН>7, рОН< 7. Зная рН, легко вычислить рОН, поскольку рН + рОН = 14.
Для качественной оценки кислотности среды применяют индикаторы.
Индикаторы представляют собой слабые органические кислоты или основания, недиссоциированные молекулы и ионы которых имеют различную окраску. Лакмус, например, содержит азолитминовую кислоту, молекулы которой красного, а анионы – синего цвета:
HInd ⇄ H+ + Ind-
красный синий
← [H+]
[OH-] →
В кислой среде лакмус окрасит раствор в красный цвет, а в щелочной – в синий.
|
|
|
Каждый индикатор имеет свою специфическую область перехода окраски. Наиболее точно измерение рН определяется универсальным индикатором, точное значение рН растворов измеряют на приборах – рН-метрах.
Пример 10. Концентрация [H+] равна 10–3 моль/л. Вычислить [OH-].
Решение: [H+]·[ OH- ] = 10-14; [OH-] = 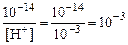 моль/л.
моль/л.
Пример 11. Концентрация [OH-] равна 2,5·10–12 моль/л. Вычислить рН раствора.
Решение: [H+] = 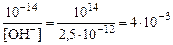 моль/л;
моль/л;
рН = –lg [H+] = –lg 4·10–3 = 2,4.
При расчетах рН в растворах слабых электролитов следует учитывать степень их диссоциации.
Пример 12. Вычислить рН в растворе 0,1М NH4OH (Kдис=1,8·10–5).
Решение: Из закона разбавления Оствальда следует, что Сион = 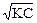 , тогда
, тогда
[OH-] = 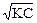 =
= 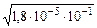 =1,3·10–3 моль/л;
=1,3·10–3 моль/л;
[H+] = 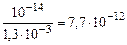 ; рН = –lg [H+] = –lg 7,7·10–12 = 11,11.
; рН = –lg [H+] = –lg 7,7·10–12 = 11,11.
 2015-06-14
2015-06-14 2076
2076








