Появление избыточной энергии на поверхности раздела фаз связано с некомпенсированостью межатомного, межмолекулярного взаимодействия в твердых и жидких поверхностях.
Избыток энергии на поверхности проявляется в появлении поверхностного натяжения.
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ, стремление в-ва (жидкости или твердой фазы) уменьшить избыток своей потенциальной энергии на границе раздела с др. фазой (поверхностную энергию). Определяется как работа, затрачиваемая на создание единицы площади пов-сти раздела фаз (размерность Дж/м2). Согласно др. определению, поверхностное натяжение-сила, отнесенная к единице длины контура, ограничивающего пов-сть раздела фаз (размерность Н/м); эта сила действует тангенциально к пов-сти и препятствует ее самопроизвольному увеличению.
Единица его измерения в системе СИ: 1Н/м (ньтонах на метр = 1 Дж/м2, или миллиньтонах на метр.
Поверхностное натяжение имеет двойной физический смысл — энергетический (термодинамический) и силовой (механический). Энергетическое (термодинамическое) определение: поверхностное натяжение — это удельная работа увеличения поверхности при её растяжении при условии постоянства температуры. Силовое (механическое) определение: поверхностное натяжение — это сила, действующая на единицу длины линии, которая ограничивает поверхность жидкости.
|
|
|
По поверхностному натяжению пластовых жидкостей на различных поверхностях раздела можно судить о свойствах соприкасающихся фаз, закономерностях взаимодействия жидких и твёрдых тел, процессах адсорбции, количественном и качественном составе полярных компонентов в жидкости, интенсивности проявления капиллярных сил и т.д.
Прибор для измерения поверхностного натяжения называется тензиометр.
Энергетическое состояние любой системы и возможность протекания тех или иных процессов описывается термодинамическими потенциалами.
Соответствующие дифференциалы термодинамических потенциалов:
· для внутренней энергии
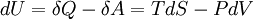 ,
,
· для энтальпии
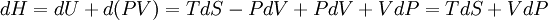 ,
,
· для свободной энергии Гельмгольца
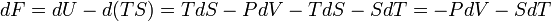 ,
,
· для потенциала Гиббса
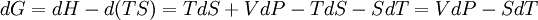 .
.
Эти выражения математически можно рассматривать как полные дифференциалы функций двух соответствующих независимых переменных. Поэтому естественно рассматривать термодинамические потенциалы как функции:
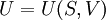 ,
,
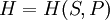 ,
,
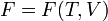 ,
,
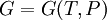 .
.
Хими́ческий потенциа́л μ — один из термодинамических параметров системы, а именно энергия добавления одной частицы в систему без совершения работы. Определение химического потенциала можно записать в виде:
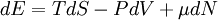
где Е — энергия системы, S — её энтропия, N — количество частиц в системе.
Эта формула определяет, кроме химического потенциала μ, также давление P и температуру T.
|
|
|
Можно доказать, что химический потенциал задаётся формулой
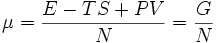 ,
,
где G — потенциал Гиббса
Для поверхности раздела фаз функцию химического потенциала выполняет поверхностное натяжение.
 2015-06-14
2015-06-14 1981
1981








