Поскольку энергия видимого света сравнительно невелика, то, следовательно, необходимым условием окрашенности соединения является наличие так называемых рыхлосвязанных электронов. Как правило, легче возбуждаются электроны в ионах с незавершенной электронной оболочкой, т.е. в том случае, когда есть неспаренные электроны. Так почти все соединения элементов побочных подгрупп периодической системы, у которых валентность обычно не совпадает с номером группы, являются окрашенными. Иными словами, окрашенными обычно являются соединения элементов с незавершенными d - орбиталями.
Каждый электронный слой с главным квантовым числом 3 имеет набор из пяти d - орбиталей, отличающихся пространственным расположением (рисунок 16) [7,34].
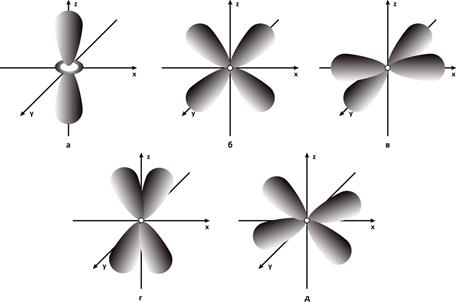
а - 3dz2-орбиталь; б - 3dxz-орбиталь; в - 3dx2y2-орбиталь; г - 3dyz-орбиталь; д - 3dху-орбиталь
Рисунок – Схемы пространственного расположения d - атомных орбиталей
Если катион d – элемента не находится в окружении заряженных групп, то все пять орбиталей энергетически эквивалентны. Таким образом, d – электрон может с одинаковой вероятностью находиться на любой из пяти орбиталей. Однако, если катион находится под влиянием электростатического поля отрицательных зарядов, окружающих его и расположенных в вершинах октаэдра, тетраэдра или занимающих в пространстве другие фиксированные положения, d – орбитали не будут энергетически эквивалентны. Наиболее энергетически выгодными будут орбитали, максимально удаленные от отрицательных зарядов, т.е. будет иметь место так называемое расщепление d – орбиталей в электростатическом кристаллическом поле на уровни разной энергии. Переход электрона с одного уровня на другой вследствие расщепления d – орбиталей в электростатическом кристаллическом поле носит название d – d перехода.
|
|
|
d – d Переходом обусловлена зеленая окраска оксида хрома (III) и изумрудной зелени, где ион Cr3+ имеет строение внешнего электронного слоя 3s23p63d3 и его основное состояние расщепляется в поле лигандов на три уровня. Таким переходом вызвана окраска медянки, где ион Cu2+ имеет строение внешнего электронного слоя 3s23p63d9 и его основное состояние расщепляется на два уровня. При синтезе диоксида титана предгидролизный раствор имеет интенсивную фиолетовую окраску, вызванную присутствием ионов [Ti(H2O)6]3+, где конфигурация внешнего электронного слоя у титана 3s23p63d1. Ион титана находится в октаэдрическом поле лигандов, и его d – орбиталь расщепляется на два уровня.
 2015-06-14
2015-06-14 2808
2808








