| Название и символ | Определение | Размерность | Формула | Примечание |
| Массовая доля растворенного вещества В, (B) | Отношение массы растворенного вещества В (mB) к массе раствора (mР). | Безразмерная величина | 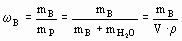
| (NaOH) = 0,2 или (NaOH) = 20% в 100 масс.ч. раствора содержится 20 масс. ч.NaOH |
| Молярная доля растворенного вещества В, xB | Отношение количества второго вещества (nB) к суммарному количеству всех веществ, входящих в состав раствора, включая растворитель ( ni = nB + n1 + n2 +... ni) | Безразмерная величина | 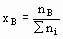
| xHCl = 0,02 или xHCl = 2% - содержание хлороводорода равно двум молярным процентам |
| Моляльность вещесства В в растворе, Cm(B) | Отношение количества растворенного вещества В (nB) к массе растворителя (mB) в кг | моль/кг = Мн | 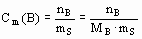
| Cm(H2SO4) = 0,1 моль/кг Cm(H2SO4) = 0,1 Мн в растворе на 1 кг H2Oприходится 0,1 мольH2SO4. Раствор называют децимолярным |
| Молярная концентрация вещества В, CB | Отношение количества растворенного вещества В (nB) к объему раствора (VР) | моль/л = М | 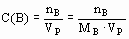
| C(KCl) = 2 моль/л C(KCl) = 2 М - в 1 л раствора содержится 2 моль KCl |
| Молярная концентрация эквивалентов вещества В,Cэк(B) | Отношение количества эквивалентов растворенного вещества В (nэк) к объему раствора (VР) | моль/л = н | 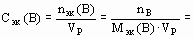
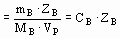
| Cэк(Na2CO3) = 0,01моль/л Cэк(Na2CO3) = 0,01 н в 1 л раствора содержится 0,01 моль эквивалентов Na2CO3 - сантимолярный раствор |
| Произведение молярной концентрации эквивалентов вещества В (Cэк(B)) на объем раствора (VР) равно количеству эквивалентов этого вещества (nэк(B)). Поэтому закон эквивалентов: nэк(A) + nэк(B) для растворов имеет вид: Cэк(A)·VP(A) = Cэк(B)·VP(B). Это уравнение очень часто используют в расчетах, особенно в аналитической химии. | ||||
| Титр раствора вещества B | Концентрация стандартного раствора, равная массе вещества В (mB), содержащегося в 1 мл раствора | г/мл | 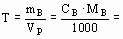
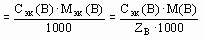
| T(NaCl) = 0,0250 г/мл в 1 мл раствора содержится 0,0250 гNaCl |
Способы выражения состава растворов
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
|
|

Сейчас читают про:
 2015-06-14
2015-06-14 278
278







