Задача 1. Написать уравнение электролиза раствора KCl, если анод нерастворимый.
 Решение: KCl↔K+ +Cl-
Решение: KCl↔K+ +Cl-
Катод (-) Анод (+)
2H2O+2e↔ H2↑+2OH 2Cl-2e↔Cl2
Суммарное ионное уравнение:
2Н2О + 2С1 → Н2↑ + С12↑ + 2ОН
Суммарное молекулярное уравнение:
2КС1 + 2Н2О→ 2Н2↑ + С2↑+ 2КОН
Вторичный продукт электролиза
Задача 2. Написать уравнение реакции электролиза водного раствора AgNO3, если
а) анод нерастворимый;
б) анод растворимый, серебряный.
Решение:
а) анод нерастворимый AgNO3↔ Ag + + NO3
катод(-)…………………………………….анод(+)
 Ag++1e→Ag0 2H2O-4e→O2+4H+
Ag++1e→Ag0 2H2O-4e→O2+4H+
Суммарное уравнение процессов:
4AgNO3 + 2H2O→4Ag + О2+4 HNO 3
Вторичный продукт электролиза
б) анод растворимый, серебряный
 катод(-) анод(+)
катод(-) анод(+)
 Ag++1e→Ag Ag0-1e→Ag+
Ag++1e→Ag Ag0-1e→Ag+
Суммарное уравнение электролиза с растворимым анодом написать нельзя.
Расчет количества веществ, разложенных или образовавшихся в процессе электролиза, производится по закону Фарадея. Теоретически массы веществ, испытавших изменение при электролизе, определяются соотношением:
|
|
|
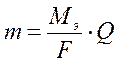
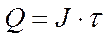
Q – количество прошедшего электричества
m – масса вещества, г.
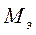 - химический эквивалент вещества, г.
- химический эквивалент вещества, г.
J – сила тока, А
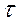 - время электролиза, сек.
- время электролиза, сек.
Пример: Сколько меди выделяется при пропускании через раствор ее соли тока силой 6А, в течение 1 часа, если выход по току составляет 98%?
m(Си)факт = m(Си)теор 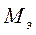 (Cu)*J*τ/96500*0,98 = 7 г.
(Cu)*J*τ/96500*0,98 = 7 г.
Следовательно, на катоде выделится 7 грамм меди.
Опыт 1. Электролиз водного раствора сульфата меди с медным анодом.
Электролиз водного раствора сульфата меди с медным анодом.
Опыт проводите в стакане, который закрывается эбонитовой крышкой, снабженной двумя клеммами для закрепления электродов (см. рис. 1).
Рис. 1. Электролизный стакан.
1.









 Раствор электролита
Раствор электролита
2. 

 Анод.
Анод.
3. 

 Катод.
Катод.
 | |||||||||||||||||||||
 | |||||||||||||||||||||
 |  |  | |||||||||||||||||||
 | |||||||||||||||||||||
 | |||||||||||||||||||||
 | |||||||||||||||||||||
 | |||||||||||||||||||||
 | |||||||||||||||||||||
 | |||||||||||||||||||||
 |  | ||||||||||||||||||||
 |
Рис. 1. Электролизный стакан.
1. Раствор электролита
2. Анод
3. Катод
Тонкий медный электрод тщательно зачистите абразивным порошком, промойте проточной водой, высушите фильтрованной бумагой и взвесьте на технических весах с точность до 00,1 гр.
Закрепите с помощью зажимов оба медных электрода в крышке стакана. В стакан налейте ¾ его объема раствор состава:
CuSO4*5H2O-150 г/л.
H2SO4-50г/л.
С2H5OH-50г/л.
Опустите электроды в раствор. Электроды соедините с полюсами источника тока так, чтобы толстый был анодом. Включите, отметив по секундной стрелке часов момент, ток в цепи электролизера. Быстро при помощи реостата установите силу тока 0,5-1 А, поддерживайте её постоянной.
|
|
|
Составьте схему электролиза (см. рис. 2) и уравнение реакций, протекающих на катоде и аноде. По истечении 20 минут (в случае резкого падения тока электролиз прекратить) освободите из зажимов катод, вымойте его в проточной воде, осторожно просушите фильтрованной бумагой и снова взвесьте на технических весах. Все количественные параметры электролиза внесите в таблицу 3.
Таблица 3.
| J(A) | τ (c) | Масса катода (Cu) | mт (теор.) | mτ- mo (факт.) | η(Сu)% | |
| mo | mт | |||||
 | |||||
 | |||||
 | |||||
|
|



|











|
Рис. 5.
Пользуясь данными, данными по формуле Фарадея, рассчитайте теоретически возможное количество восстановленной на катоде меди. Считая, что масса растворенной с анода меди точно равна её количеству, осажденному на катоде, определите для этого процесса выход по току.
Контрольные вопросы.
1. В каких случаях образуются вторичные продукты при электролизе?
2. В какой последовательности и выделяются на катоде металлы при электролизе раствора, содержащего ионы Ni, Cr2+,Fe3+?
3. Какой силы должен быть ток, чтобы при пропускании его через расплав MgSO4 выделить на катоде 6 г. Магния за 10 часов? Написать уравнения электродных процессов.
4. Через последовательно соединенные электролитические ванны с платиновыми электродами пропустили ток. В первой ванне раствор серной кислоты, во второй-раствор нитрата серебра, а в третьей - раствор CuCl2. Какие продукты выделились на электродах во всех трех ваннах и сколько их получилось по массе, если в первой ванне выделится на катоде 1 мг. водорода?
5. Через водный раствор NaCl (электроды угольные) пропускали ток сначала при перемешивании раствора, а затем без перемешивания отделив в последнем случае анод от като
 2015-06-14
2015-06-14 1756
1756








