Высокотоксичные соединения шестивалентного хрома содержатся в промывных сточных водах и отработанных технологических растворах, образовавшихся в процессе хромирования, при химической обработке поверхностей стальных изделий (травление, пассирование), при анодировании изделий из алюминия и при проведении других технологических процессов.
Обработка сточных вод осуществляется в две ступени:
1) перевод (восстановление) шестивалентного хрома в трехвалентную форму;
2) осаждение трехвалентного хрома в виде гидроксида.
В качестве реагентов-восстановителей наибольшее распространение получили натриевые соли сернистой кислоты – сульфит (Na2SO3), бисульфит (NaHSO3). Кроме того, используют следующие восстановители: сульфит железа (FeSO3), диоксид серы (SO2), гидразин (N2H4) и др.
При обработке хромсодержащих сточных вод солями сернистой кислоты протекают следующие химические реакции:
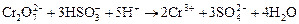 , (3.65)
, (3.65)
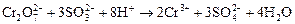 . (3.66)
. (3.66)
Скорость и полнота восстановления Cr6+ до Cr3+ указанными солями в большой степени зависит от значения рН, причем наибольшая скорость наблюдается при рН = 2 - 2,5, что требует дополнительного подкисления сточных вод. Для этих целей обычно используют 10-15 %-е растворы серной кислоты.
|
|
|
Для очистки сточных вод от шестивалентного хрома используют установки непрерывного или периодического действия.
После восстановления в кислой среде шестивалентного хрома до трехвалентного состояния сточные воды подвергают нейтрализации, при которой хром осаждается в виде гидроксида. В качестве реагентов-нейтрализаторов используют Ca(OH)2, Na2CO3 , NaOH. Во всех случаях осуществляется следующая химическая реакция:
Cr3+ + 3OH- → Cr(OH)3↓. (3.67)
Оптимальные значения рН этой реакции – 8,0 - 9,5. Cr(OH)3 обладает амфотерными свойствами и при рН ≥ 12 растворяется в избытке едкой щелочи. При этом протекает следующая химическая реакция:
Cr(OH)3 + NaOH → NaCrO2 + 2H2O. (3.68)
При использовании в качестве восстановителя сульфата двухвалентного железа (FeSO4) процесс можно проводить в кислой, нейтральной и щелочной среде:
2CrO3 + 6FeSO4 + 6H2SO4 → 2Fe2(SO4)3 + Cr2(SO4)3 + 6H2O, (3.69)
2CrO3 + 6FeSO4 + 6Ca(OH)2 + 6H2O →
→ 2Cr(OH)3↓ + 6Fe(OH)3↓ + 6CaSO4 . (3.70)
Восстановление диоксидом серы происходит по схеме
SO2 + H2O → H2SO3, (3.71)
2CrO3 + 3H2SO3 → Cr2(SO4)3 + 3H2O. (3.72)
В присутствии в сточных водах соды протекает следующая химическая реакция:
6Na2CrO4 + SO2 + Na2CO3 + n H2O →
→ Cr2O3 · n H2O + 3Na2SO4 + CO2↑. (3.73)
В результате протекания этой реакции происходит практически полное удаление шестивалентного хрома из раствора.
Реакция восстановления шестивалентного хрома гидразином протекает в нейтральной или слабощелочной среде:
4K2CrO4 + 3N2H4 → 4Cr(OH)3↓ + 3N2↑ + 8KOH. (3.74)
|
|
|
Метод восстановления применяют также для очистки сточных вод от соединений ртути. Их восстанавливают до металлического состояния, а образующуюся ртуть отделяют от воды (отстаиванием, фильтрованием или флотацией). В качестве реагента-восстановителя используют алюминиевую пудру, железный порошок, гидросульфид натрия, гидразин, сульфид железа и др.
Проведение химических методов очистки производственных сточных вод сопровождается нагревом и охлаждением материальных потоков. Методы расчета этих процессов и конструкции теплообменников изложены в книгах: Основные процессы и аппараты химической технологии: пособие по проектированию / под ред. Ю.И. Дытнерского. М.: Химия, 1991. 494 с.; Проектирование процессов и аппаратов химической технологии / И.Л. Иоффе. М.: Химия, 1991. 352 с.
Рассмотрим технологический расчет реакторов с мешалкой.
 2015-06-10
2015-06-10 2859
2859








