Метод молекулярных орбиталей (МО), давая ту же картину связей в молекуле, что и метод валентных связей, свободен от этих противоречий с опытом.
Для иллюстрации метода МО вначале рассмотрим в поле ядер (протонов A и B) один электрон. При этом образуется ион 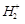 и состояние электрона в нем приближенно описывается волновой функцией (молекулярной орбиталью)
и состояние электрона в нем приближенно описывается волновой функцией (молекулярной орбиталью)
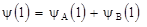 , 1.12
, 1.12
где 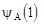 и
и 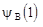 – волновые функции электрона в поле ядер A и B соответственно. Иными словами, электрон характеризуется одновременно своими волновыми функциями в поле каждого из ядер иона, одновременно принадлежит всем ядрам иона. При этом расчет дает, что ион
– волновые функции электрона в поле ядер A и B соответственно. Иными словами, электрон характеризуется одновременно своими волновыми функциями в поле каждого из ядер иона, одновременно принадлежит всем ядрам иона. При этом расчет дает, что ион 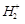 устойчив, т.е. он обладает более низким значением энергии, чем энергия свободных протона и атома водорода H2. При чем связь возникает потому, что электронный заряд концентрируется между ядрами, хотя нет никакой локализованной пары электронов (как в методе ВС). Если ввести в этот ион еще один электрон, то образуется нейтральная молекула H2. При этом состояние второго электрона в молекуле характеризуется волновой функцией
устойчив, т.е. он обладает более низким значением энергии, чем энергия свободных протона и атома водорода H2. При чем связь возникает потому, что электронный заряд концентрируется между ядрами, хотя нет никакой локализованной пары электронов (как в методе ВС). Если ввести в этот ион еще один электрон, то образуется нейтральная молекула H2. При этом состояние второго электрона в молекуле характеризуется волновой функцией 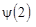 аналогичной (1.12)
аналогичной (1.12)
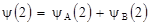 , 1.13
, 1.13
а состояние молекулы H2 описывается произведением волновых функций для первого и второго электронов:
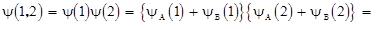
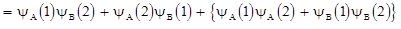 . 1.14
. 1.14
В формуле (1.14) два первых слагаемых выражают вероятность пребывания первого и второго электронов у ядра A и ядра B соответственно. Третье и четвертое слагаемые характеризуют вероятность того, что оба электрона одновременно находятся либо у ядра A, либо у ядра B, т.е. первые два слагаемых описывают ковалентную связь, а следующие два слагаемых описывают ионную связь. Таким образом, формула (1.14) показывает, что в реальных молекулах всегда присутствует в определенной пропорции смесь из ковалентной и ионной связей.
 2015-06-28
2015-06-28 285
285








