Оптические свойства атомов определяются состоянием валентных электронов. Согласно современным представлениям, электроны в атомах могут находиться лишь в некоторых состояниях, которым соответствуют строго определенные дискретные значения энергии, называемые энергетическими уровнями.
В простейшем случае, в атоме водорода имеется один единственный электрон, который является валентным электроном. Значения энергии для электрона в атоме водорода определяются формулой:
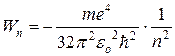 (1)
(1)
Здесь первая дробь представляет собой набор констант, а 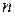 - главное квантовое число. Обозначим:
- главное квантовое число. Обозначим:
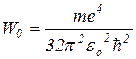 (2)
(2)
Тогда
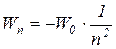 (3)
(3)
Здесь - W 0 - энергия основного состояния электрона в атоме водорода. Полезно запомнить, что W 0 = 13,6 эВ. Поэтому формулу (3)часто пишут в виде:
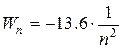 эВ (4)
эВ (4)
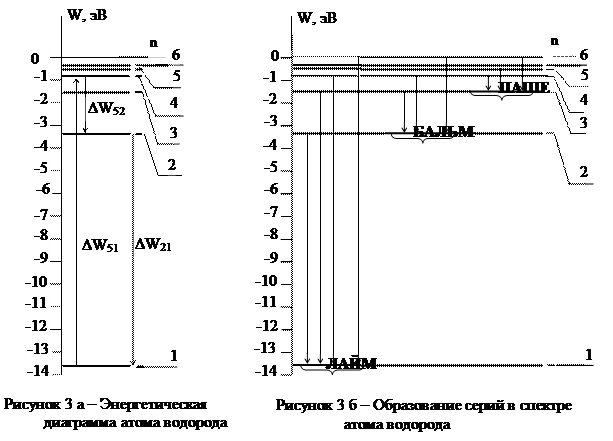
Энергетическая диаграмма атома водорода приведена на рисунке 3.а.
В случае внешних воздействий атом, т.е. фактически его электрон, может получить дополнительную энергию и перейти в одно из возбужденных состояний, энергия которых больше, чем энергия основного состояния. Такие переходы называют переходами на более высокие энергетические уровни. Из возбужденных состояний атом спонтанно, т.е. самопроизвольно, переходит в основное состояние или на один из более низких энергетических уровней, рисунок 3 б. При этом атом излучает в окружающее пространство энергию:
|
|
|
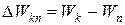 (5)
(5)
Здесь Wk - энергия атома в исходном состоянии, а Wn - энергия атома в конечном состоянии. Энергия Wkn излучается в виде кванта электромагнитного излучения,  так что
так что
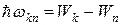 (6)
(6)
 |
Соотношение (6) часто называют правилом частот Бора.
Из соотношений (1) и (6) следует, что частота излучения равна:
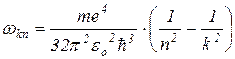 (7)
(7)
Выразив циклическую частоту 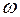 через длину волны
через длину волны 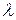 , можно записать, что
, можно записать, что
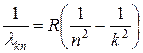 (8)
(8)
Здесь величина R = 1,0967758 107 м-1 называется постоянной Ридберга.
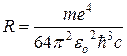 (9)
(9)
Совокупность длин волн (или частот), излучаемых телом, называют спектром излучения этого тела. Как мы видим, вследствие квантования энергетических уровней электронов в атомах, атомарные спектры излучения состоят из дискретного набора длин волн (частот). Такие спектры называются линейчатыми.
Совокупность спектральных линий, т.е. длин волн или частот, соответствующих переходам на один и тот же энергетический уровень образует серию линий. Так, например, совокупность переходов в основное состояние ( 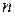 = 1) образует серию Лаймана, совокупность переходов в состояние с
= 1) образует серию Лаймана, совокупность переходов в состояние с 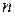 = 2, образует серию Бальмера, переходы в состояние с
= 2, образует серию Бальмера, переходы в состояние с 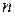 = 3, образуют серию Пашена и так далее. Видимый участок в спектре водорода целиком сосредоточен в серии Бальмера и представлен четырьмя первыми линиями в этой серии (Рис. 4). Частоты и длины волн этих линий могут быть рассчитаны по формулам (7) - (9). Линия с наибольшей длиной волны (или наименьшей частотой) называется Н (красная), следующая – Н (голубовато-зеленая), следующая ‑ Н (фиолетовая 1-ая), следующая ‑ Н (фиолетовая 2-ая) и т. д.
= 3, образуют серию Пашена и так далее. Видимый участок в спектре водорода целиком сосредоточен в серии Бальмера и представлен четырьмя первыми линиями в этой серии (Рис. 4). Частоты и длины волн этих линий могут быть рассчитаны по формулам (7) - (9). Линия с наибольшей длиной волны (или наименьшей частотой) называется Н (красная), следующая – Н (голубовато-зеленая), следующая ‑ Н (фиолетовая 1-ая), следующая ‑ Н (фиолетовая 2-ая) и т. д.
|
|
|
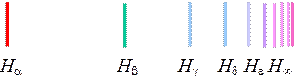
Рисунок 4. – Схема линий серии Бальмера для водорода
 2015-06-28
2015-06-28 838
838








