Кислотные свойства соединений типа Н–А зависят от
· прочности связи Н – А;
· электроотрицательности фрагмента А;
· факторов, обуславливающих стабильность аниона А– по сравнению с НА.
При этом последнее обстоятельство имеет решающее значение. Стабильность образующихся анионов возрастает с увеличением заряда ядра и объема электронных облаков. Чем меньше плотность отрицательного заряда фрагмента А, тем легче молекуле НА «потерять» протон в виде Н3О+. И наоборот, осуществить обратный процесс – извлечь протон из Н3О+ – для аниона А– тем легче, чем больше плотность отрицательного заряда. Поэтому, например, йодистоводородная кислота H-I сильнее, чем фтористоводородная H-F. Следовательно, рост кислотных свойств соединений НА осуществляется в следующих направлениях:
рост кислотных свойств
H–C H–N H–O H–F
H–Si H–P H–S H–Cl
H–Br
H–I
Нам известно, что у воды значение р К а=15.74 (см. раздел 4.1) Значение для этанола р К а = 15.93. Поскольку этанол по кислотным свойствам слабее воды, то этокси-анион С2Н5О– является более сильным основанием, чем гидроксильная группа. Следовательно, равновесие:

 С2Н5О– + Н2О С2Н5ОН + НО–
С2Н5О– + Н2О С2Н5ОН + НО–
смещено вправо и этокси-анион может существовать только в безводных условиях.
Введение электроноакцепторных заместителей в молекулы спиртов приводит к большей стабилизации образующегося аниона, что приводит к росту кислотности:
| Спирт
| р К а
|
| СН3СН2ОН
| 15.93
|
| CH2ClCH2OH
| 14.31
|
| CHCl2CH2OH
| 12.80
|
| CCl3CH2OH
| 12.24
|
Фенолы примерно на пять порядков по кислотности сильнее спиртов. Для фенола значение р К а = 9.98. Это связано с возможностью стабилизации образующегося фенолят-аниона:

Карбоновые кислоты примерно на десять порядков превосходят спирты по кислотным свойствам. Для уксусной кислоты р
К а = 4.76. Причина – стабилизация карбоксильного аниона за счет равномерного распределения отрицательного заряда на ядрах кислорода:
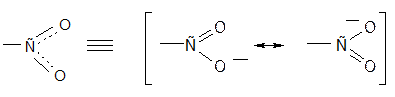
Введение электроноакцепторных заместителей приводит к увеличению кислотных свойств. Например, значения р К а 1 двухосновных кислот ниже значения р К а соответствующих одноосновных кислот. Группа –СООН проявляет отрицательные индукционный (– I) и резонансный(– C) эффекты.(Cм. Таблицу 9).
Таблица 9
Сравнение одноосновных и двухосновных карбоновых кислот
|
Одноосновные кислоты
|
р К а
|
Двухосновные кислоты
|
р К а 1
|
| Н-СООН
муравьиная
| 3.77
| НОСО-СООН
щавелевая
| 1.23
|
| СН3-СООН
уксусная
| 4.76
| НОСО-СН2-СООН
малоновая
| 2.83
|
| СН3-СН2-СООН
пропионовая
| 4.88
| НОСО-СН2-СН2СООН
янтарная
| 4.19
|
На стабилизацию образующихся анионов может оказывать влияние образование внутримолекулярной водородной связи. Это, например, проявляется при сравнении кислотности фумаровой и малеиновой кислот.

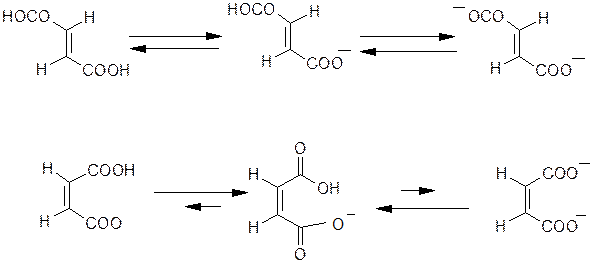
Из приведенной схемы следует, что р К а 1 =3.02 (фумаровая к-та) > р К а 1 =1.92 (малеиновая к-та), ар К а 2 = 4.38 (фумаровая к-та) < р К а 2 = 6.23 (малеиновая к-та). Это связано с тем, что моноанион малеиновой кислоты стабилизируется за счет внутримолекулярной водородной связи.
 H–C H–N H–O H–F
H–C H–N H–O H–F

 С2Н5О– + Н2О С2Н5ОН + НО–
С2Н5О– + Н2О С2Н5ОН + НО–
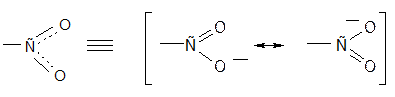

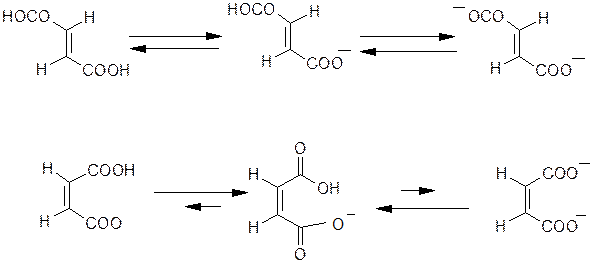
 2015-06-24
2015-06-24 1414
1414








