В отличие от кислот Бренстеда для кислот Льюиса практически отсутствует количественная оценка кислотности. Предлагается примерная последовательность уменьшения кислотности в ряду:
BX3 > AlX3 > FeX3 > GaX3 > SbX3 > SnX4 > AsX5 > ZnX2 >HgX2
Для объяснения большого числа экспериментальных данных было предложено разделить кислоты и основания Льюиса на жесткие и мягкие. Легкость протекания кислотно-основного взаимодействия зависит не только от силы кислоты и основания, но и от их «жесткости» и «мягкости».
Принцип теории жестких и мягких кислот и оснований (ЖМКО): «жесткие» кислоты преимущественно взаимодействуют с «жесткими» основаниями, а «мягкие» кислоты – с «мягкими» основаниями.
Жесткая кислота – акцепторный атом маленького размера, не имеющий неподеленных электронных пар, низкой поляризуемости, высокой электроотрицательности (H+, Li+, Na+, AlCl3, …).
Мягкая кислота – акцепторный атом большого размера, с низким положительным зарядом, имеющий на валентных оболочках неподеленные электронные пары(Cu+, Ag+, Hg2+, …).
Ряд уменьшения мягкости кислот:
Hg2+ > Ag+ > CH3Hg > Cd2+ > Zn2+ > Ni 2+ > Fe 3+ > Cu+ > Mg2+ > K+ > Na+ > Li+ > H+
Жесткое основание – донорный атом с высокой электроотрицательностью, низкой поляризуемостью, трудно окисляемый, прочно удерживающий валентые электроны (HO–, F–, …).
Мягкое основание – донорные атомы с низкой электороотрицательностью, высокой поляризуемостью, легко окисляемые, слабо удерживающие валентные электроны (I–, Br–, RS–, …).
Ряд уменьшения мягкости оснований:
I– >Br– > Cl–> S2– > RS– > CN– > H2O > C5H5N > CH3COO– > F– > NH3 > HO –
Степень жесткости или мягкости оснований можно определить из равновесия
|
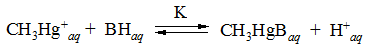
Протон Н+ – простейшая жесткая кислота; катион метилртути СН3Нg+ – мягкая кислота. Если константа равновесия К > 1, то основание В мягкое основание, а если К< 1 В – жесткое.
Аналогично можно оценить жесткость или мягкость кислоты М:
|
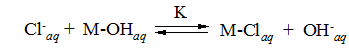
Анион хлора Cl- – мягкое основание; гидроксил-анион НО- – жесткое основание. Поэтому, если К > 1, кислота М мягкая, а при К< 1 М – жесткая кислота.
При помощи концепции ЖМКО можно предсказать возможность протекания некоторых реакций. Например, взаимодействие трифторйодметана с фтористым метилом в газовой фазе:
 CF3–I + CH3–F CF3–F + CH3–I
CF3–I + CH3–F CF3–F + CH3–I
Ион CF3+ более жесткая кислота, чем ион СН3+, а анион F– более жесткое основание, чем анион йода I–. Поэтому жесткая кислота CF3+ будет предпочтительнее координироваться с более жестким основанием F–, а мягкая кислота CH3+ будет предпочитать мягкое основание I–. Действительно, данная реакция приводит к образованию тетрафторметана CF4 и йодистого метила CH3I (с отрицательным значением энтальпии ∆Н = –75.4 кДж/моль).
[12] Брёнстед Йоханнес Николаус (1879-1946) – датский физико-химик.
 2015-06-24
2015-06-24 8059
8059