| Определе-ние | Ÿ - совокупность окислительно-восстановительных процессов, протекающих при прохождении постоянного электрического тока через расплав или раствор электролита; при электролизе энергия электрического тока преобразуется в химическую энергию - характер протекания электродных процессов при электролизе зависит от многих факторов: материала электродов, состава электролита, режима электролиза (температура, напряжение, плотность тока и др.) |
| Знаки зарядов электродов | Ÿ как и в гальваническом элементе, электрод на котором идет процесс окисления называется анодом, восстановление – катодом. Но знак заряда анода положительный, катода – отрицательный. |
| Материал электродов: |     а)нерастворимые (инертные) электроды – в процессе электролиза химически не окисляются (не растворяются), а служат лишь для передачи электронов во внешнюю цепь (обычно изготавляются из графита, платины и платиновых металлов, золота, диоксида свинца, оксида рутения и т.д. Вследствие высокой анодной поляризации в качестве нерастворимых анодов можно использовать железо и никель в щелочной среде, свинец в растворах содержащих ион SO42¯, титан, тантал, нержавеющую сталь;
б)растворимые (активные) электроды сами принимают участие в процессе – посылают во внешнюю цепь электроны за счет окисления атомов металла, из которого изготовлены: а)нерастворимые (инертные) электроды – в процессе электролиза химически не окисляются (не растворяются), а служат лишь для передачи электронов во внешнюю цепь (обычно изготавляются из графита, платины и платиновых металлов, золота, диоксида свинца, оксида рутения и т.д. Вследствие высокой анодной поляризации в качестве нерастворимых анодов можно использовать железо и никель в щелочной среде, свинец в растворах содержащих ион SO42¯, титан, тантал, нержавеющую сталь;
б)растворимые (активные) электроды сами принимают участие в процессе – посылают во внешнюю цепь электроны за счет окисления атомов металла, из которого изготовлены:
 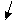 Ме - nē = Меn+ Ме - nē = Меn+
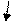 анод во внешнюю в раствор
цепь
(изготовляются из меди, серебра, никеля и других металлов).
анод во внешнюю в раствор
цепь
(изготовляются из меди, серебра, никеля и других металлов).
|
| Электролиз расплава электролита (электроды инертные) | а) при высоких температурах образуется расплав и соль диссоциирует на ионы: NaCl ó Na+ + Cl¯;
б) катионы металла направляются к катоду, а анионы кислотного остатка – к аноду:
Катод (-): Na+; Анод (+): Сl¯ ;
в) на катоде происходит восстановление:
Катод (-): Na+ + ē = Na
г) на аноде происходит окисление:
Анод (+): 2Сl¯ - 2ē = Cl2
электролиз
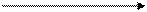 2NaCl 2Na0 + Cl20
(расплав) 2NaCl 2Na0 + Cl20
(расплав)
|
| Электролиз раствора электролита | Процессы на катоде:
а) если 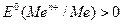 , то в первую очередь восстанавливаются катионы металла:
Меn+ + nē = Ме
б) если , то в первую очередь восстанавливаются катионы металла:
Меn+ + nē = Ме
б) если 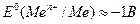 , то восстанавливаются молекулы воды (в кислой среде – ионы Н+):
нейтральная среда (pH 7): 2Н2О + 2ē = Н2 + 2ОН¯;
кислая среда (pH < 7): 2Н+ + 2ē = Н2.
в) при значениях , то восстанавливаются молекулы воды (в кислой среде – ионы Н+):
нейтральная среда (pH 7): 2Н2О + 2ē = Н2 + 2ОН¯;
кислая среда (pH < 7): 2Н+ + 2ē = Н2.
в) при значениях 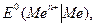 лежащих внутри указанных выше интервалов, могут восстанавливаться и катионы металла, и молекулы воды:
Меn+ + nē = Ме
и
2Н2О + 2ē = Н2 + 2ОН¯
Процессы на инертном аноде:
а) в первую очередь окисляются простые бескислородные анионы (кроме F¯) для которых значения стандартного электродного потенциала
меньше ≈ 1,5 В:
S2- - 2ē = S0; 2J¯ - 2ē = J20;
б) при электролизе водных растворов, содержащих анионы кислородсодержащих кислот (PО43-, SO42-, NO3¯ и др.) или гидроксоанионы, на аноде окисляются молекулы воды или ионы ОН¯:
нейтральная среда (pH 7): 2Н2О - 4ē = О2 + 4Н+;
щелочная среда (pH> 7): 4ОН¯- 4ē = О2 + 2Н2О.
в) при растворимом аноде окисляется металл, из которого изготовлен анод:
Ме – nē = Меn+
(с последующими восстановлением на катоде: Меn+ + nē = Ме). лежащих внутри указанных выше интервалов, могут восстанавливаться и катионы металла, и молекулы воды:
Меn+ + nē = Ме
и
2Н2О + 2ē = Н2 + 2ОН¯
Процессы на инертном аноде:
а) в первую очередь окисляются простые бескислородные анионы (кроме F¯) для которых значения стандартного электродного потенциала
меньше ≈ 1,5 В:
S2- - 2ē = S0; 2J¯ - 2ē = J20;
б) при электролизе водных растворов, содержащих анионы кислородсодержащих кислот (PО43-, SO42-, NO3¯ и др.) или гидроксоанионы, на аноде окисляются молекулы воды или ионы ОН¯:
нейтральная среда (pH 7): 2Н2О - 4ē = О2 + 4Н+;
щелочная среда (pH> 7): 4ОН¯- 4ē = О2 + 2Н2О.
в) при растворимом аноде окисляется металл, из которого изготовлен анод:
Ме – nē = Меn+
(с последующими восстановлением на катоде: Меn+ + nē = Ме).
|
| Законы электролиза (законы Фарадея) | Ÿ 1ый закон: массы веществ m, выделяющихся на электродах, прямо пропорциональны количеству прошедшего через раствор электричества q. m = k · q или m = k ·I·τ, где I – сила тока, τ – время прохождения тока, k – электрохимический эквивалент (k =Mэ/F; F – постоянная Фарадея), или m = M I τ /n F, М – молярная масса, n– число отданных или принятых одной частицей (ионом) электронов; Ÿ 2ой закон: при пропускании равного количества электричества через растворы или расплавы различных электролитов массы веществ, выделяющихся на электродах, пропорциональны молярным массам их эквивалентов Мэ |
Электролиз
|
|

Сейчас читают про:
 2015-06-26
2015-06-26 353
353







