Пролин. Осмолит пролин широко распространен в растениях. Эта аминокислота может синтезироваться двумя путями, в которых исходным веществом для синтеза является либо глутамат, либо орнитин (рис. 8.4). Ключевой фермент глутаматзависимого пути синтетаза ∆'-пирролин-5-карбоновой кислоты обладает двойной функцией. Сначала благодаря свойственной этому ферменту γ-глутамилкиназной активности происходит АТФ-зависимое фосфорилирование L-глутамата. Образующийся L-глутамил- γ -фосфат превращается далее в γ -полуальдегид глутаминовой кислоты (ПАГ) с помощью этого же фермента, функционирующего как НАДФН-зависимая ПАГ-дегидрогеназа. Далее ПАГ подвергается спонтанной циклизации с образованием ∆'-пирролин-5-карбоновой кислоты (П5К), восстанавливающейся затем до пролина при участии НАДФН-зависимой П5К-редуктазы.
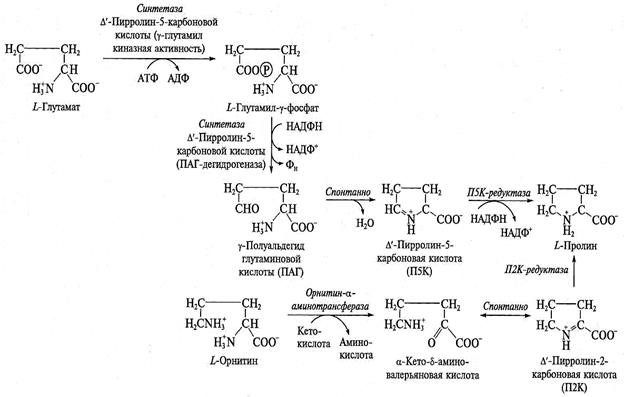
Рис. 8.4. Биосинтез пролина
В орнитинзависимом пути биосинтез пролина из орнитина начинается с реакции переаминирования, катализируемой орнитин-α-аминотрансферазой. Образующаяся α-кето-δ-аминовалерьяновая кислота спонтанно превращается в ∆'-пирролин-2-карбоновую кислоту (П2К), которая далее с помощью П2К-редуктазы восстанавливается до пролина.
В катаболическом превращении пролина ключевую роль играет пролиндегидрогеназа, которая катализирует окисление пролина до ∆'-пирролин-5-карбоновой кислоты.
Глицин-бетаин образуется в клетках многих водорослей и высших растений. Метаболический путь биосинтеза глицин-бетаина обнаружен у всех исследованных представителей семейства маревые (Chenopodiaceae), однако в клетках растений других семейств глицин-бетаин синтезируется лишь у отдельных видов.
В отличие от пролина и других осмолитов, внутриклеточные концентрации которых регулируются путем баланса скоростей их синтеза и катаболизма, однажды образовавшийся глицин-бетаин не подвергается катаболическим превращениям. Считается, что внутриклеточные концентрации глицин-бетаина зависят от скорости его биосинтеза и скорости оттока через флоэму к растущим тканям.
Глицин-бетаин образуется в хлоропластах из холина. Процесс протекает в две стадии (рис. 8.5). Первый фермент, холинмонооксигеназа, катализирует окисление холина до бетаинальдегида, используя фотосинтетически восстановленный ферредоксин и молекулярный кислород. Второй фермент, бетаинальдегиддегидрогеназа, катализирует окисление бетаинальдегида до глицин-бетаина. Оба фермента выделены, очищены и получены клоны их кДНК. Как показали эксперименты с мечеными предшественниками глицин-бетаина, активность обоих ферментов увеличивается в несколько раз при повышении осмотического давления наружного раствора, при этом возрастают количества их транскриптов. При последующем снабжении растений пресной водой содержание транскриптов снижается.
Холин, предшественник глицин-бетаина, образуется в разных растениях неодинаково (рис. 8.5). В шпинате (Spinacia oleracea) и сахарной свекле (Beta vulgaris) синтез холина осуществляется путем метилирования этаноламинфос-фата с образованием холинфосфата. Последний гидролизуется, образуя холин. В шпинате активность ферментов, вовлеченных в этот путь биосинтеза холина, возрастает при повышении наружной концентрации соли. В ячмене (Hordeum vulgare) холин образуется через обмен фосфатидилхолина — фосфолипида, входящего в состав мембран (рис. 8.5).
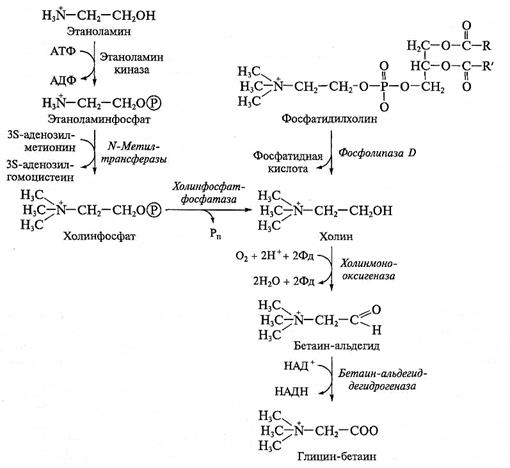
Рис. 8.5. Биосинтез глицин-бетаина
Накопление глицин-бетаина в клетках способствует повышению засухо- и солеустойчивости растений. Растения, накапливающие глицин-бетаин при водном дефиците и солевом стрессе, поддерживают относительное содержание воды (ОСВ) и тургорное давление на более высоком уровне, а также осуществляют фотосинтез с большей скоростью, чем растения, не накапливающие
его. Подавляющее большинство сельскохозяйственных культур не аккумулирует глицин-бетаин. Были сделаны попытки повысить засухо- и солеустойчивость ряда растений путем получения трансформантов с генами ферментов, отвечающих за биосинтез глицин-бетаина. Растения табака (Nicotiana tabacum), трансформированные геном бактериальной холиндегидрогеназы, отвечающей за превращение холина в бетаин-альдегид, демонстрировали более высокую скорость роста при солевом стрессе, чем исходные растения.
Маннитол. Многоатомный спирт маннитол представляет собой восстановленную форму сахара маннозы. Он встречается у многих растений, а у некоторых из них на его долю приходится большая часть всех углеводов, образующихся при фотосинтезе. Концентрации маннитола возрастают в клетках в ответ на гиперосмотический шок. В отличие от глицин-бетаина содержание маннитола в клетках регулируется не только скоростью его биосинтеза, но и активностью ферментов, которые отвечают за утилизацию маннитола, а также ферментов, осуществляющих его катаболизм. Например, у злаков осмотический шок приводит к снижению активности НАД+-зависимой маннитолдегидрогеназы — фермента, окисляющего маннитол.
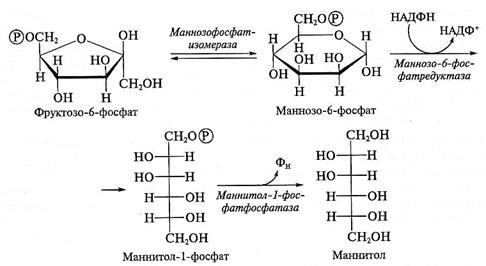
Рис. 8.6. Биосинтез маннитола
На рис. 8.6 показан путь биосинтеза маннитола. В условиях осмотического стресса три фермента осуществляют превращение интермедиата цикла Кальвина и гликолиза — фруктозо-6-фосфата — в маннитол. Фруктозо-6-фосфат с помощью маннозо-6-фосфатизомеразы превращается в маннозо-6-фосфат, который затем восстанавливается до маннитол-1-фосфата НАДФН-зависимой
маннозо-6-фосфатредуктазой. Маннитол-1-фосфат дефосфорилируется при участии маннитол-1-фосфатфосфатазы, превращаясь в маннитол.
Превращение маннитола во фруктозо-6-фосфат в катаболической ветви цикла в ответ на повышение наружного осмотического давления происходит с участием двух ферментов:
НАД+-зависимая маннитолдегидрогеназа окисляет маннитол до фруктозы, а фруктокиназа катализирует образование фруктозо-6-фосфата из фруктозы.
Растения табака и арабидопсиса (Arabidopsis thaliana), чувствительные к осмотическому шоку, были трансформированы геном из Е. coli, отвечающим за превращение фруктозо-6-фосфата в маннитол-1-фосфат. Трансформированные растения накапливали маннитол, который обычно они не содержат, и демонстрировали более высокую устойчивость к осмотическому шоку, чем нетрансформированные растения. Семена аккумулирующих маннитол трансгенных растений арабидопсиса были способны прорастать в присутствии соли.
Пинитол. D-пинитол — циклический многоатомный спирт, основной осмолит многих растений семейств сосновые (Pinaceae), бобовые (Leguminosae) и гвоздичные (Caryophyllaceae). Концентрации пинитола, как правило, более высоки у видов, адаптированных к засухе и почвенному засолению. Пинитол накапливается в клетках факультативного галофита хрустальной травки (Mesembryanthemum crystallinum), если растение поливают раствором, содержащим NaCl. При поливе раствором NaCl в концентрации 400 мМ доля пинитола в клетках М. crystallinum достигает 70 % от всех растворимых карбогидратов и лишь 5 % — в клетках контрольных растений, не обработанных NaCl. В клетках пинитол локализован в хлоропластах и цитозоле, но не обнаруживается в вакуолях.
Пинитол образуется из глюкозо-6-фосфата (рис. 8.7). Главное событие в цепи реакций биосинтеза пинитола — о -метилирование миоинозитола, которое осуществляется
миоинозитол-6- о -метилтрансферазой. В этой реакции донором метильной группы служит S-аденозилметионин. Образующийся ононитол подвергается далее эпимеризации с образованием пинитола.
При выращивании М. crystallinum в присутствии NaCl возрастание концентрации пинитола в клетках сопровождалось почти 60-кратным увеличением активности миоинозитол-6-о-метилтрансферазы. Показано, что активность этого фермента регулируется на транскрипционном уровне, т. е. увеличение активности фермента, вызванное высоким осмотическим давлением среды, связано с возрастанием количества его мРНК в клетках.
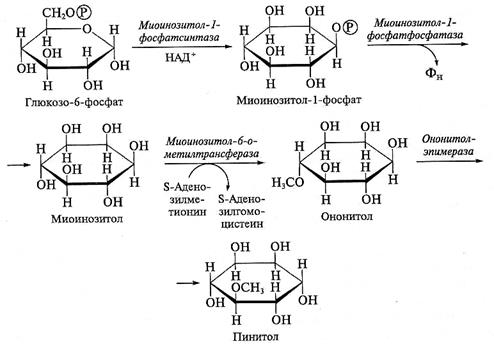
Рис. 8.7. Биосинтез пинитола
Полиамины спермидин и спермин. Предшественником спермидина и спермина является диамин путресцин, образующийся из аминокислоты орнитина. (рис. 8.8). Спермидин образуется в результате конденсации молекулы путрес-цина и пропиламинного остатка декарбоксилированного S-аденозилметиони-на. Реакция осуществляется с помощью спермидинсинтазы за счет богатой энергией метил-сульфониевой связи декарбоксилированного S-аденозилметионина. Другой фермент, сперминсинтаза, переносит на спермидин еще один пропиламинный остаток декарбоксилированного S-аденозилметионина с образованием спермина.
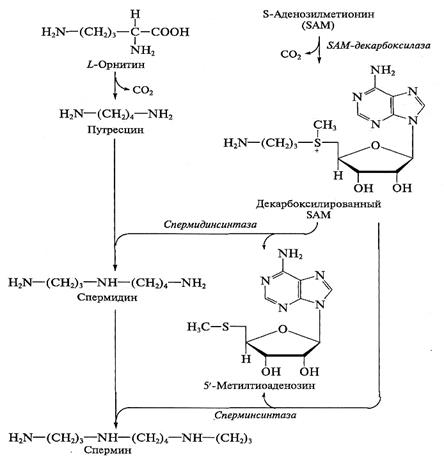
Рис. 8.8. Биосинтез полиаминов
 2015-06-26
2015-06-26 2977
2977








