В биологических системах часто встречается механизм регуляции активности энзимов с помощью ковалентной модификации в их аминокислотных остатках. Быстрый и широко распространённый способ подобного явления - фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы серина активного и аллостерического центров фермента. Фосфорилирование тоже требует работы биокатализаторов и осуществляется ферментами протеинкиназами, а дефосфорилирование - фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению заряда и конформации контактной площадки и её каталитической способности. При этом результат может быть двояким: работа одних при фосфорилировании стимулируется, других же, напротив, подавляется (рис. 25). Например, адреналин фосфорилирует ключевые ферменты синтеза и распада гликогена, в результате последний процесс ускоряется, а формирование гомополисахарида угнетается.
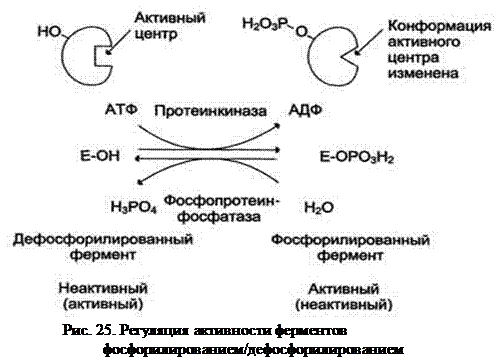
Изменение скорости реакции, вызванное фосфорилированием энзима, обратимо. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро изменять направленность хода процесса в зависимости от возникающих условий. Антагонистичные по функции гормоны по-разному влияют на направленность реакции, вызывая противоположные эффекты в метаболизме.
 2015-06-26
2015-06-26 528
528








