 |  | ||
2. Кінази Csk-родини. Csk-родина тирозинових кіназ у клітинах імунної системи представлена однією кіназою Csk (від англ. С terminal Src kinase — кіназа С-кінця Src) — негативним регулятором кіназ Src-родини. За своєю будовою Csk нагадує кінази Src-родини, однак вона не має залишку тирозину на С-кінцевому «хвості» і міристинової кислоти на N-кінці молекули. Тому вона є цитоплазматичною кіназою і постійно перебуває в активованому стані. Тобто у випадку фосфорилювання С-кінцевих тирозинів у молекулі Src за участі Csk- кінази Src є неактивними.
Активація кіназ родини Src (рис.6.15). Як було встановлено Src-кінази містять SH 2, SH3 домени, що передують кіназному SН1 домену.В інактивованому стані кіназний домен обмежений взаємодією з обома SH2, SH3 доменами, які стримують активність домену SН1. Власне SH2 домен взаємодіє з фосфорильованим тирозином на С-кінці кіназного домену, а SH3 домен взаємодії з пролін - збагаченим лінкером (між SH2 і кіназним SH1 доменом). Вивільнення SH2 або SH3 домену може активувати кіназну активність. Дефосфорилювання С-кінцевого тирозину фосфатазою CD 45 приводить до вивільнення SH2 домену і активації кінази. А також зв’язування ліганда з SH3 доменом приводить до вивільнення останнього від зв’язку з кіназним доменом і активації ферменту. А фосфорилювання цього ж тирозину Csk- кіназами або втрата SH3 ліганда повертає Src-кіназу в інактивований стан.
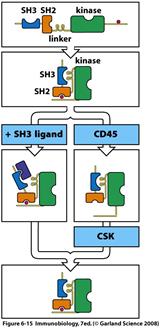 |
Фосфорилювання Src кіназ контролюється фосфатазою СD45. Цей білок є в усіх клітинах крові крім еритроцитів. Таким чином, активність тирозинової кінази, що знаходиться безпосередньо під рецептором, залежить від балансу активностей фосфатази СD45 і кінази Сsk. Про важливість такої взаємодії для нормальної життєдіяльності клітини свідчить той факт, що СD45 складає до 10% всіх поверхневих білків Т лімфоциту.
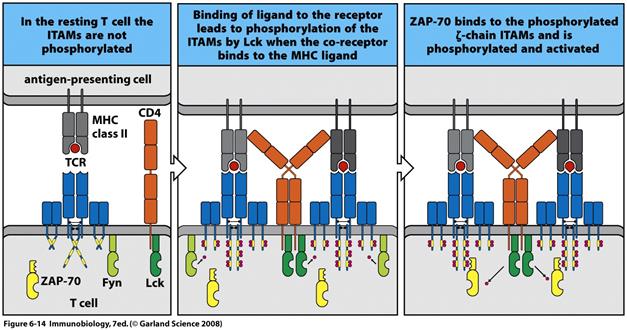
3. Кінази родини Syk/ZAP-70. Syk працює в В лімфоцитах, а ZАР-70 (ζ – chain – associated protein) в Т лімфоцитах. Ці кінази не мають у своєму складі жирних кислот і не зв'язані з мембраною. Вважають, що вони приймають естафету від Srс кіназ: взаємодіють із фосфорильованими ІТАМs і передають сигнал далі на адапторні білки. Характерною ознакою кіназ цієї родини є наявність розміщених один за одним двох SH2 – доменів.
За допомогою тандему з двох SH2-доменів кінази Syk/Zap-70-родини здатні специфічно взаємодіяти з двома фосфорильованими тирозинами, що входять до складу ІТАМ. По суті, фосфорильовані послідовності ІТАМ є специфічними сайтами для взаємодії з кіназами Syk/Zap-70-родини. Після того як кінази Src-родини фосфорилюють цитоплазматичні частини СD3 або Іgα/Іgβ, до цих частин приєднуються кінази Syk/Zap-70-родини. Так, було показано, що Zap-70 приєднується до ζ-ланцюга СD3 і фосфорилюється і активується кіназою Lck.
 |
4. Кінази Януса: Jak 1, 2, 3 і Туk2 працюють iз іншими рецепторами імунних клітин - рецепторами для ростових факторів і інтерлейкінів.
5. Кінази Тес-родини. Представники кіназ Тес-родини за будовою дуже нагадують кінази Src-родини, однак, на відміну від останніх, вони не містять N-кінцевого залишку міристинової кислоти. Замість нього у них є N-кінцевий РН-домен. РН-домени здатні приєднуватися до мембрани під час взаємодії з ФІФЗ, тому кінази Тес-родини можуть знаходитися як у цитоплазмі, так і в контакті з мембраною клітини, залежно від наявності у клітинній мембрані ФІФЗ. Отже, при активації в клітині РІЗ-кінази, яка утворює ФІФЗ, кінази Тес-родини приєднуються до мембрани і залучаються в процес передачі сигналу.
У пацієнтів із тяжкими формами імунодефіцитів, наприклад з хворобою Брутона, знайдено мутації в генах, що кодують кінази Тес-родини (Btk). Функцією кіназ цієї родини є активація фосфоліпази Сγ, причому різні представники Тес-родини активують різні ізоформи фосфоліпаз.
У Т-клітинах знайдено щонайменше три представники кіназ Тес-родини — Тес, Itk і Rlk/Тхk. У В-клітинах найважливішу функцію в процесі передачі сиґналу виконує інший представник цієї родини — кіназа Btk.
 2015-07-04
2015-07-04 315
315








