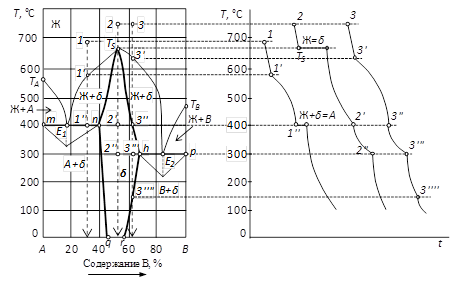
Диаграммы состояния систем, компоненты которых образуют химические соединения переменного состава (бертоллиды) показаны на рис. 37 и 38. Переменный состав химического соединения на диаграмме состояния обозначен областью «δ» и может рассматриваться как твердый раствор, у которого «хозяином» кристаллической решетки является химическое соединение S (показано пунктиром: на рис. 36– точка 2, на рис. 38 – точка 3), в кристаллическую решетку которого внедрены избытки компонентов. Таким образом, бертоллиды, т.е. соединения нестехиометрического состава, можно рассматривать как различного типа твердые растворы.
Рис. 36. Диаграмма состояния двухкомпонентной конденсированной системы с образованием химического соединения переменного состава, плавящегося без разложения.
На изотермах диаграммы протекают эвтектические процессы, связанные с совместной кристаллизацией бертоллида и одного из компонентов. На изотерме m-n реализуется равновесие  ; на изотерме h-p в точке эвтектики Е 2 происходит кристаллизация по уравнению:
; на изотерме h-p в точке эвтектики Е 2 происходит кристаллизация по уравнению: 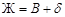 .
.
|
|
|
 |
Конгруэнтно плавящийся бертоллид обладает индивидуальной температурой плавления TS. Положение точки плавления бертоллида соответствует составу химического соединения, являющегося хозяином кристаллической решетки. Соответственно на кривой охлаждения (точка 2) присутствует температурная остановка при температуре TS. Изменение состава твердой фазы приводит к нелинейному ходу зависимости температуры от времени.
Рис. 37. Диаграмма состояния двухкомпонентной конденсированной системы с образованием химического соединения переменного состава, плавящегося с разложением.
Немонотонный характер кривой охлаждения точки 2 связан с увеличением доли компонентов А и В (участок 2-2'), снижением доли компонента В (участок 2'-2'') и уменьшением количества обоих компонентов (участок 2''-2 k) в бертоллиде как твердом растворе.
На диаграмме (рис. 37) имеются две изотермы, на которых в безвариантном равновесии находятся три фазы, между которыми протекают фазовые реакции. Одна из них связана с кристаллизацией эвтектики 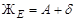 , на другой изотерме протекает перитектическая реакция образования химического соединения (при охлаждении) или его разложения (при нагревании):
, на другой изотерме протекает перитектическая реакция образования химического соединения (при охлаждении) или его разложения (при нагревании): 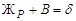 .По диаграмме можно определить, какие фазы находятся в равновесии в каждом ее поле.
.По диаграмме можно определить, какие фазы находятся в равновесии в каждом ее поле.
 2015-07-04
2015-07-04 1021
1021








