При антифосфолипидном синдроме в крови циркулируют антитела против фосфолипидов или фосфолипид-связанных белков. При этом синдроме возникает лабораторный феномен, при котором происходит удлинение времени свертывания крови в тестах, выполняемых на фосфолипидах (АЧТВ, ПВ). Этот феномен впервые был описан у пациентов с системной красной волчанкой и поэтому получил название волчаночного антикоагулянта. Клинически, однако, при антифосфолипидном синдроме и волчаночном антикоагулянте нет геморрагических проявлений, но есть выраженная тенденция к патологически усиленному тромбооб-разованию. Нельзя ставить знак равенства между
волчаночным антикоагулянтом и антифосфоли-пидным синдромом. В некоторых случаях при ко-агулологических признаках волчаночного антикоагулянта не находят иммунологических признаков антифосфолипидного синдрома, в свою очередь антифосфолипидный синдром не всегда сопровождается коагулологическими признаками волчаночного антикоагулянта.
|
|
|
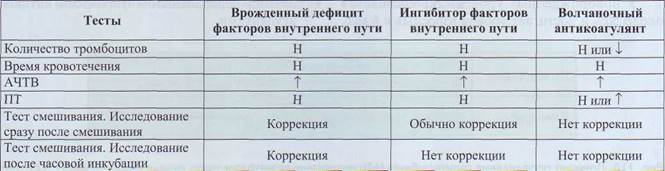
Антифосфолипидный синдром, сопровождающийся волчаночным антикоагулянтом, выявляют комбинацией фосфолипид-зависимых коагуляци-онных и иммунохимических методов, причем надежная диагностика обеспечивается только комплексным использованием группы тестов. Как правило, волчаночныи антикоагулянт распознается по удлинению фосфолипид-зависимых коагуляцион-ных тестов. Волчаночныи антикоагулянт является неспецифическим ингибитором. При подозрении на волчаночныи антикоагулянт необходимо начинать лабораторные анализы со екрининговых тестов и теста смешивания. В табл. 29 представлены данные екрининговых тестов при врожденном дефиците факторов VIII и IX, при наличии специфического ингибитора и волчаночном антикоагулянте. Важно помнить, что не все реактивы для проведения АЧТВ одинаково чувствительны к волчаночному антикоагулянту. Для анализа АЧТВ при подозрении на волчаночныи антикоагулянт необходимо применять реактивы, содержащие каолин, но не эллаговую кислоту.
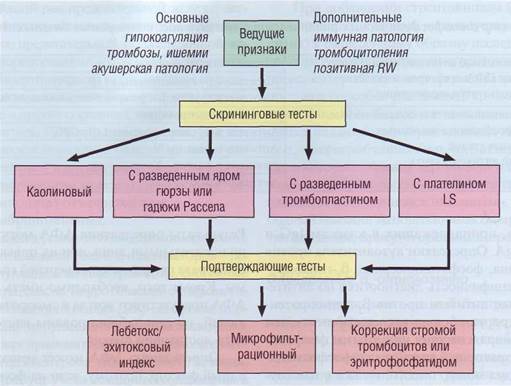
Выявление волчаночных антикоагулянтов проводят последовательно: сначала в екрининговых методах, а затем в подтверждающих. На рис. 120 представлен алгоритм выявления вол-

 Таблица 29
Таблица 29
Изменения екрининговых тестов при врожденном дефиците факторов VIII и IX, наличии специфического ингибитора и волчаночном антикоагулянте
Обеспечение диагностики нарушений гемостаза в КДЛ
|
Рис. 120. Алгоритм выявления волчаночных антикоагулянтов
чаночного антикоагулянта (Баркаган З.С., Мо-мот А.П., 1999).
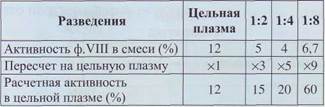
Еще одним подтверждающим тестом для определения волчаночного антикоагулянта является тест разведения. В серии последовательных разведений анализируемой плазмы буфером активность факторов свертывания крови, определяемая коагуля-ционным методом, относительно возрастает при наличии волчаночного антикоагулянта (табл. 30).
|
|
|
Таблица 30
Эффект разведения на активность факторов
свертывания в присутствии волчаночного
антикоагулянта
Для подтверждения диагноза волчаночного антикоагулянта необходимо провести подтверждаю-
щие тесты, например тест нейтрализации на тромбоцитах. Проводится определение АЧТВ и активности факторов внутреннего пути плазмы больного до и после инкубации с тромбоцитами здорового донора или эритрофосфатидом. При наличии волчаночного антикоагулянта АЧТВ сокращается, а активность факторов возрастает за счет связывания части антифосфолипидных антител на тромбоцитах здорового человека. В группу подтверждающих внесены также индексы, основанные на сравнении результатов фосфолипид-зависимьгх и фосфолипид-не-зависимых тестов (лебетокс/эхитоксовый индекс).
Для уточнения диагноза антифосфолипидно-го синдрома необходимо провести определение кардиолипиновых антител с использованием метода ELISA. В табл. 31 представлен перечень антифосфолипидных антител, которые выявляются ИФА и коагуляционным методом.
Определение антифосфолипидных антител (АФА)
АФА, выявляемые твердофазным ИФА, представляют собой различные комбинации иммуно-
Обеспечение диагностики нарушений гемостаза в КДЛ
Таблица 31
Спектр антифосфолипидных антител, присутствующих в сыворотке больных А ФС

|
глобулинов, принадлежащих к классам IgG и IgM, реже IgA. Определяют аутоантитела против кардиолипина, фосфатидилсерина, β2-гликопро-теина I. Специфичность диагностики по антителам различна: антитела против β2-гликопротеи-на I демонстрируют большую специфичность, чем антитела к кардиолипину или другим фосфоли-пидам. Лабораторный диагноз антифосфолипид-ного синдрома можно ставить только в том случае, если содержание диагностических аутоанти-тел в сыворотке крови, выявленных иммунофер-ментным методом, подтверждает патологию повторно с интервалом, по крайней мере, в 6 недель.
Результаты определения АФА могут считаться положительными лишь при их повышении в 2 и более раза по сравнению с верхней границей нормы. Кроме того, необходимо иметь в виду, что АФА присутствуют всегда в сыворотке здоровых людей, но они заблокированы гистонами и их титр достаточно низкий.
Определению АФА может мешать ревматоидный фактор, поэтому, если на фоне клинических признаков заболевания иммунохимические тесты на АФА дают отрицательный результат, то необходимо провести коагулянтные тесты на наличие волчаночного антикоагулянта.
Тесты аля исслелования фибринолитической системы
 ■
■
.■.. ■ ■
Основным функциональным ферментом фиб-ринолиза является плазмин. При лизисе фибрино-вого сгустка плазминоген и его активаторы фиксируются на фибрине, где идет активное расщепление субстрата, тогда как в плазме фибринолиз слабо выражен, плазмин блокирован а2-антиплаз-мином.
Спонтанный эуглобулиновый лизис
Спонтанный эуглобулиновый лизис - традиционный метод оценки фибринолиза. В кислой среде при низкой температуре происходит осаждение эуглобулиновой фракции белков плазмы, содержащей фибриноген, факторы свертывания, плазминоген и его активаторы (рис. 121). Ингибиторы фибринолиза выпадают в осадок в незначительном количестве (около 2%). После растворения эуглобулиновой фракции и образования фиб-
ринового сгустка определяют время его лизиса, что отражает фибринолитическую активность плазмы. Укорочение времени лизиса эуглобулинов (активация фибринолиза) отмечается при:
|
|
|
• уменьшении концентрации фибриногена -
гипо- и дисфибриногенемия;
• увеличении содержания плазминогена и его ак
тиваторов - панкреатит, панкреонекроз, мета-
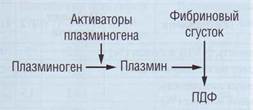
Рис. 121. Компоненты фибринолитической системы, которые определяют результаты метода «спонтанный эуглобулиновый лизис»
Обеспечение диагностики нарушений гемостаза в КДЛ
стазирующии рак предстательной железы, легкого, яичников, метастазы меланомы, операции на легких, предстательной, поджелудочной железе, гиперкатехоламинемия (стресс, тиреотоксикоз, гипертонический криз, введение адреналина), шок, патология беременности, терминальные и другие состояния, сопровождающиеся развитием ДВС-синдрома, цирроз, рак, метастатическое поражение печени (снижение ан-типлазминовой и антиактиваторной функции). Увеличение времени лизиса эуглобулинов (угнетение фибринолиза) отмечается при:
• гиперфибриногенемии;
• врожденной а-, гипо- или дисплазминогенемии;
• дефиците плазминогена и его активаторов - ре
цидивирующие венозные тромбозы, системные
васкулиты, сепсис, нефротический синдром, ги-
покоагуляционная стадия ДВС-синдрома, цир
роз печени (нарушение синтеза плазминогена).
Тест может применяться при фибринолитичес-
кой терапии для контроля эффективности лечения. Метод требует учета исходного содержания в плазме фибриногена, так как при снижении фибриногена время лизиса укорачивается, что трактуется ошибочно как гиперфибринолиз. При гиперфибриногенемии время лизиса удлиняется. Поэтому при отклонениях содержания фибриногена в плазме, а также неполноценной полимеризации фибрина и гепаринемии возможно получение ошибочных результатов. В связи с ориентировочным характером и недостаточной специфичностью в последнее время вместо теста спонтанного лизиса эуглобулинового сгустка начали использовать определение отдельных факторов фибринолиза, в первую очередь плазминогена.
Определение плазминогена
Дефицит плазминогена - один из потенциальных факторов риска тромбоза, хотя клинически это подтверждается не всегда.
|
|
|
При добавлении стрептокиназы (бактериальный препарат, который используется как тромбо-литик) к разведенному образцу исследуемой плазмы образуется плазминоген-стрептокиназный комплекс, который обладает ферментативной активностью и способен расщеплять хромогенный субстрат (рис. 122). Ферментативная активность комплекса плазминоген-стрептокиназа не подавляется α2-макроглобулином и α2-антиплазмином. Тесты, в которых сначала переводили плазминоген в плазмин, а затем пытались определить активность плазмина, не получились надежными, так как свободный плазмин мгновенно инактивируется α2-ан-типлазмином, присутствующим в пробе.
Определение α2 -антиплазмина
α2 -антиплазмин - самый быстрый «реактивный» ингибитор плазмина, он не позволяет присутствовать плазмину в крови в свободном виде. α2 -антиплазмин, помимо плазмина, ингибирует активаторы плазминогена - урокиназу (u-РА) и тканевой активатор (t-PA). Дефицит α2-антиплазмина встречается относительно редко, но если возникает, то это сопровождается тяжелым геморрагическим синдромом, проявляющимся диапедезными кровотечениями. Основной причиной кровотечений является присутствие свободного плазмина, который разрушает все тромбы и деградирует фибриноген.
Определение α2-антиплазмина вместе с определением ингибитора тканевого активатора плазминогена типа 1 (PAI-1), XIII фактора можно рассматривать как тесты 2-го уровня, которые необходимо выполнять, если скрининговые тесты (ПВ, АЧТВ, ТВ и определение функции тромбоцитов) нормальны, а больной страдает кровотечениями.
Уменьшение содержания (активности) α2 -ан-типлазмина наблюдается при:
• врожденном (наследственном) дефиците;
• заболеваниях печени (нарушается синтез α2-ан-
типлазмина);

 Рис. 122. Принцип определения плазминогена хромогенным методом. СК - стрептокиназа
Рис. 122. Принцип определения плазминогена хромогенным методом. СК - стрептокиназа
Обеспечение диагностики нарушений гемостаза в КДЛ
• ДВС-синдроме;
• лейкозах;
• нефротическом синдроме;
• интенсивной тромболитической терапии, ко
торая может вызвать потребление α2-анти-
плазмина.
После экстракорпорального кровообращения с использованием АИК может наблюдаться истощение α2-антиплазмина, что приводит к ги-перфибринолизу, сочетающемуся с истощением фибриногена, деградацией плазмином плазменных белков (в том числе факторов гемостаза), разрушением тромбоцитов и кровотечениями.
Принцип определения α2-антиплазмина подобен технологиям определения других ингибиторов (рис. 123). Так как происходит быстрая инактивация плазмина α2-антиплазмином, то стадия ингибирования и стадия измерения стартуют практически одновременно (что позволяет повысить специфичность метода при сниженной активности ингибитора в плазме).
 2015-07-04
2015-07-04 1997
1997








