26. Определить количество теплоты, которое необходимо для нагревания при V = const 25 г кислорода, находящегося при 3500 С от 1013 до 5065 ГПа.
27. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 800 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
Са(ОН)2 кр = СаОт + Н2Ог, ∆Н0800
28. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 900 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
СаСО3 т = СаОт + СО2 г, ∆Н0900
29. Определить работу адиабатического сжатия 1 моля двухатомного идеального газа при повышении температуры от 15 до 250 С.
30. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 800 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
Са(ОН)2 кр = СаОт + Н2Ог, ∆Н0800
31. Теплоты образования воды и водяного пара равны соответственно -285,8 и – 241, 8 кДж/моль. Рассчитать теплоту испарения 1,8 кг воды при 25 0С.
|
|
|
32. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 600 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
СО + Cl2 г = СОCl2 г, ∆Н0600
33. Медь плавится при 1065 0С, теплота плавления равна 179,9 Дж/г. К 1 кг меди, взятому при 15 0С, подведено 541,2 кДж. Истинная удельная теплоемкость меди Ср = 0,3563 + 9,88 10-5 Т Дж/(г× К). Какое количество меди расплавится?
34. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 500 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
2NO2 г = 2NO г + O2 г, ∆Н0500
35. Средняя удельная теплоемкость СО2 при постоянном давлении в интервале температур от 0 до 1000 0С выражается уравнением Ср = 1,003+10,27 10-5Т + 19,41 103 Т-2 Дж/(г× К). Найти истинную молярную теплоемкость СО2 при 500 0С.
36. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 1200 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
СО2 г+ Н2 г = СО г+ Н2O г, ∆Н01200
37. Тепловые эффекты реакций при 0 0С и постоянном давлении 1013 ГПа:
С + О2 г = СО2 г -405,8 кДж;
СО + 1/2О2 г = СО2 г -284,5 кДж;
Н2 + 1/2О2 г = Н2Ог -246,8 кДж.
Рассчитать при тех же условиях тепловые эффекты следующих реакций:
Сграф +1/2О2 г = СОг, ∆Н1;
С + 2 Н2Ог = СО2 г + 2Н2 г, ∆Н2;
С + Н2Ог = СО г + Н2 г, ∆Н3;
2СО г = С + СО2 г, ∆Н4.
38. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 2000 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
|
|
|
2СО2 г = СО г+ O2 г, ∆Н02000
39. Теплота образования Fe2O3 т составляет -821,3 кДж/моль, а теплота образования Al2O3 равна – 1675,0 кДж/моль. Рассчитать тепловой эффект реакции восстановления 1 моля Fe2O3 т металлическим алюминием.
40. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 1000К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
СО + 3Н2 г = СН4 г + Н2Ог, ∆Н01000
41. Теплота сгорания аморфного углерода, графита и алмаза соответственно равны – 409,2; -394, 6 и -395,3 кДж/моль. Рассчитать теплоту аллотропного превращения: 1) аморфного углерода в графит; 2) аморфного углерода в алмаз; 3) графита в алмаз.
42. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 600К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
СН4 г + СО2 г = 2СО г +2Н2 г, ∆Н0600
43. Вычислить тепловой эффект реакции восстановления оксида железа (2) водородом, пользуясь следующими данными:
FeOт + СОг = FeOт +СО2 г, ∆Н = 13,18 кДж/моль;
СО + 1/2О2 г = СО2 г -284,5 кДж;
Н2 г+ 1/2О2 г = Н2Ог -246,8 кДж.
44. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 700 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
2Н2 г + СО г = СН3ОН г, ∆Н0700
45. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 800 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
3Fe3O4 кр + 8Al кр = 4 Al2О3 т + 9Fe т, ∆Н0800
46. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 800 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А)
MgO т + Н2 г = Mg т + Н2Ог, ∆Н0800
47. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 1000 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А)
Fe2O3 кр + 2Al кр = Al2О3 т + 2Fe т, ∆Н01000
48. Вычислите изменение энтропии при нагревании 16 кг кислорода от 273 до 373 К: 1) при постоянном объеме; 2) при постоянном давлении. Считать кислород идеальным газом.
49. Определить тепловой эффект химической реакции при различных температурах при температуре Т = 600 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А)
2H2S г + 3O2 г = 2SO2 г+ 2Н2Ог, ∆Н0600
50. Рассчитать изменение энтропии при нагревании 58,82 кг В2О3 от 298 до 800 К, теплоемкость В2О3 С0р = 36,5525 + 106,345 10-3Т Дж/(моль×К).
51. Твердый хлороводород (HCl) претерпевает фазовый переход при 98,36 К, при этом энтальпия изменяется на 1,19 кДж/моль. Рассчитайте молярную энтропию и внутреннюю энергию фазового перехода.
52. Выразить константу равновесия химической реакции (К). 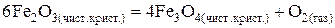 . Возможна ли данная реакция при Т = 1800 К, если
. Возможна ли данная реакция при Т = 1800 К, если 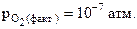 ?
?
53. Выразить константу равновесия химической реакции (К) 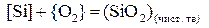 (приняв расплав идеальным). Будет ли окисляться кремний в атмосфере воздуха
(приняв расплав идеальным). Будет ли окисляться кремний в атмосфере воздуха 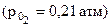 при Т = 1800 К и
при Т = 1800 К и 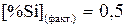 ?
?
54. Определите изменение энтропии, если 100×10-3 кг воды, взятой при 273 К, превращается в пар при 390 К. Удельная теплота испарения воды при 373 К равна 2263,8×103 Дж/кг; удельная теплоемкость жидкой воды 4,2 Дж/(кг×К); удельная теплоемкость пара при постоянном давлении 2,0×103 Дж/(кг×К).
55. Выразить константу равновесия химической реакции (К). 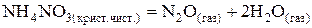 . Возможно ли осуществление данной реакции при Т = 1000 К, если
. Возможно ли осуществление данной реакции при Т = 1000 К, если 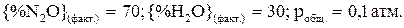 ?
?
56. Выразить константу равновесия химической реакции (К).
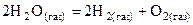 . Будет ли разлагаться водяной пар при
. Будет ли разлагаться водяной пар при 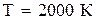 , если
, если 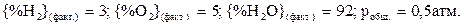 ?
?
57. Выразить константу равновесия химической реакции (К) 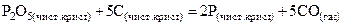 . Возможен ли прямой процесс при Т = 1000К и
. Возможен ли прямой процесс при Т = 1000К и 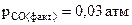 ?
?
|
|
|
58. Бромбензол (С6Н5Br) кипит при 429,8 К, его теплота парообразования при этой температуре 241,9 103 Дж/кг. Рассчитайте изменение энтропии при испарении 10 кг бромбензола.
59. Выразить константу равновесия химической реакции (К)
C6H6(чист. жидк.) +7,5O2 (газ) = 6СО2(газ)+ 3Н2О(газ). Возможно ли горение бензола при Т = 2000 К и 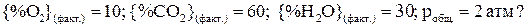
60. Рассчитайте изменение энтропии в процессе смешения 5 кг воды при температуре Т1 = 353 К с 10 кг воды при Т2 = 290 К. Теплоемкость воды считать постоянной и равной 4,2 Дж/(моль×К).
61. Выразить константу равновесия химической реакции (К)
С(чист. графит.)+2N2O(газ)= СО2(газ)+2N2(газ). Возможна ли данная реакция при Т = 2000К, если  ?
?
62. Выразить константу равновесия химической реакции (К)
2(FeО) + [Si] = 2[Fe](чист.)+ (SiO2), приняв расплав идеальным. Будет ли окисляться кремний при T = 2200K, если в металле [%Si] = 2; в шлаке (% FeO) = 10, (% SiO2) = 30?
63. Выразить константу равновесия химической реакции (К)
2H2S (газ)+ 3O2(газ)= 2H2O (газ)+ 2SO2(газ). Возможна ли данная реакция при Т = 1800К, если {%SO2}(факт.)= 11,5; 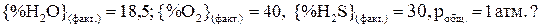
64. Выразить константу равновесия химической реакции (К)
2CaF2(чист.)+ SiO2(чист.)= 2СаО (чист.)+ SiF4 (г). Будет ли выделяться фтористый кремний SiF4в атмосферу при Т = 2000К и 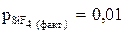 атм?
атм?
65. Выразить константу равновесия химической реакции 2[Mn] + {O2} = 2(MnO) (чист) . Окислится ли марганец в расплаве при Т = 2800 К, если 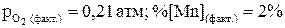 (расплав считать идеальным)?
(расплав считать идеальным)?
66. Выразить константу равновесия химической реакции (К)
CuO (крист. чист.)+ СОг = Сu (крист. чист.)+ СО2 г. Возможна ли реакция при Т = 2100К, если %{CO}(факт.)= 80; {%CO2}(факт)= 20; pобщ.= 2 атм?
67. Выразить константу равновесия химической реакции (К)
СaCO3 (чист. крист.)= СaO(чист. крист.)+ СО2 (г). Будет ли осуществляться данная реакция при Т = 3600К и 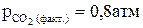 ?
?
68. Выразить константу равновесия химической реакции
2H2(г)+ O2(г)= 2Н2О (г). Возможна ли диссоциация Н2О при Т = 1500 К, если pобщ.= 0,5 атм., {%H2}(факт.)= 20, {%O2}(факт.)= 10, {%H2O}(факт.)= 70?
69. Выразить константу равновесия химической реакции (К).
FeO (чист. крист.)+ Н2(г)= Fe (чист. крист.) + Н2О (г). Будет ли происходить восстановление оксида железа при Т = 2100 К, если {%H2}(факт.)= 90; {%H2O}(факт.)= 10; pобщ.= 0,8 атм?
|
|
|
70. Выразить константу равновесия химической реакции (K)
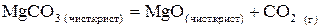 . Возможен ли прямой процесс при Т = 2800 К, если
. Возможен ли прямой процесс при Т = 2800 К, если 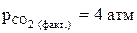 ?
?
71. Выразить константу равновесия химической реакции (К)
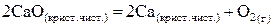 . Возможно ли разложение оксида кальция при Т = 3200 К,
. Возможно ли разложение оксида кальция при Т = 3200 К, 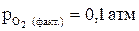 ?
?
72. Выразить константу равновесия химической реакции (К)
NiO (чист. крист.)+ СО (г)= Ni (чист. крист.)+ СО2(г). Возможна ли данная реакция в прямом направлении при Т = 2000К и {%СО}(факт.)= 90, {%CO2}(факт.)= 10, робщ= 0,6 атм?
73. Выразить константу равновесия химической реакции (К)
2[Al] + 3[O] = Al2O3 (чист. крист.), cчитая расплав идеальным. Вычислить константу равновесия химической реакции при Т = 2200 К, если известно, что 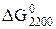 = -390 кДж. Будет ли окислятся алюминий при Т = 2200К, если в стали 0,015%[Al] и 0,15%[O]?
= -390 кДж. Будет ли окислятся алюминий при Т = 2200К, если в стали 0,015%[Al] и 0,15%[O]?
74. Выразить константу равновесия химической реакции (К)
SiO2 (чист. крист.) + H2 (г) = Si (чист. крист.) + H2O (г). Возможна ли данная реакция в обратном направлении при Т = 2500 К и {%H2O} (факт.)= 10, {%H2} (факт.)= 90, pобщ.= 1,2 атм?
75. Определить расчетным путем возможность протекания приведенной химической реакции при заданной температуре.
Т = 1500 К 2 MnOт = 2 Mnт + O2 г
6.2. ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К ЗАЧЕТУ
- Термодинамика как раздел физической химии. Понятие о физических и химических процессах в условиях сварки. Общие понятия химической термодинамики: термодинамическая система, параметры системы, термодинамические функции системы (U, H), формы передачи энергии (работа, теплота).
- 1-й закон термодинамики (общее положение). 1-й закон термодинамики для изопроцессов (изохорного и изобарного). Изобарный и изохорный тепловые эффекты.
- 1-й закон термодинамики (общее положение). Закон Гесса и его следствия.
- Энтальпия – термодинамическая функция. Энтальпия образования химических соединений. Тепловой эффект химической реакции. Факторы, влияющие на тепловой эффект химической реакции.
- Зависимость теплового эффекта химической реакции от температуры (уравнение Кирхгофа). Пояснить зависимость для разных соотношений теплоемкостей исходных веществ и продуктов реакции.
- Расчет теплового эффекта химической реакции при изобарном нагреве, если молярные теплоемкости исходных веществ и продуктов реакции зависят от температуры (уравнение Кирхгофа).
- Фазовые превращения 1-го рода. Влияние их на тепловой эффект реакции при увеличении температуры.
- Необратимые и обратимые процессы. Характер изменения энтропии в данных процессах.
- Второй закон термодинамики. Энтропия – термодинамическая функция. Определение изменения энтропии в адиабатических системах.
- Определительное уравнение энтропии. Расчет энтропии вещества при изобарном нагреве от 298 К до заданной температуры (Т), если изобарная молярная теплоемкость вещества (Ср) зависит от температуры.
- Расчет энтропии вещества при изобарном нагреве от 298 к до Т, если молярная теплоемкость вещества не зависит от температуры (Ср = const).
- Физический смысл энтропии. Энтропия как степень упорядоченности системы Уравнение Больцмана.
- 3-й закон термодинамики.
- Расчет изменения энтропии в химических равновесиях.
- Фазовые превращения 1-го рода. Влияние их на изменение энтропии вещества при изобарическом нагреве.
- Энергия Гиббса – критерий направленности процессов и равновесия. Зависимость энергии Гиббса от давления и температуры (уравнение Гиббса-Гельмгольца).
- Химическое сродство. Изменение свободной энергии Гиббса – мера химического сродства. Энтальпийный и энтропийный факторы химического сродства.
- Стандартное химическое сродство (ХС) элементов к кислороду. Зависимость ХС к кислороду от температуры. Принцип высокотемпературного углетермического способа получения чистых металлов.
- Нестандартное состояние вещества. Растворы. Идеальные и реальные растворы. Активность вещества в растворах. Коэффициент активности веществ.
- Молярная доля и молярные проценты вещества в растворе. Массовая доля и массовый процент вещества в растворе.
- Термодинамическая система (определение). Экстенсивные и интенсивные свойства системы Парциальные мольные величины в растворах. Химический потенциал вещества как парциальная мольная величина.
- Растворы. Разбавленные растворы. Закон Рауля.
- Растворы. Совершенные растворы. Закон Рауля.
- Реальные растворы. Зависимость давления насыщенного пара реального раствора с отрицательным отклонением от идеальности от состава раствора (для бинарного раствора).
- Совершенные растворы. Зависимость давления насыщенного пара совершенного раствора от состава (для бинарного раствора).
- Нестандартное состояние вещества. Химический потенциал вещества в нестандартном состоянии. Нестандартный химический потенциал и термодинамическая активность конденсированных веществ.
- Нестандартный химический потенциал и термодинамическая активность газообразных веществ.
- Равновесие. Константа равновесия – мера глубины протекания химических процессов. Зависимость константы равновесия от температуры (уравнение изобары)
- Неравновесие. Уравнение изотермы химической реакции.
- Правило фаз Гиббса – общее условие равновесия многофазных систем.
 2015-07-03
2015-07-03 1189
1189








