Уравнение, определяющее зависимость константы равновесия химической реакции от температуры, называют уравнением изобары
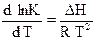 (46)
(46)
Из этого уравнения следует, что знак первой производной 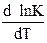 определяется знаком теплового эффекта реакции (∆Н).
определяется знаком теплового эффекта реакции (∆Н).
а) ∆Н > 0, Т – растет, К – увеличивается;
б) ∆Н < 0, Т – растет, К – уменьшается;
в) ∆Н = 0, Т – растет, К – постоянно.
Расчет химического сродства (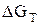 ) в нестандартных условиях. Уравнение изотермы
) в нестандартных условиях. Уравнение изотермы
Значения 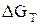 находят по уравнению изотермы химической реакции
находят по уравнению изотермы химической реакции
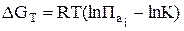 , (47)
, (47)
где К – константа равновесия химической реакции; 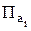 – произведение фактических активностей записывается также, как константа равновесия, но в выражение входят не равновесные, а фактические активности реагентов.
– произведение фактических активностей записывается также, как константа равновесия, но в выражение входят не равновесные, а фактические активности реагентов.
Согласно этому уравнению возможны варианты:
а) 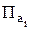 < К,
< К, 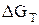 < 0 – реакция идет в прямом направлении;
< 0 – реакция идет в прямом направлении;
б) 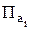 > К,
> К, 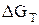 > 0 – возможна только обратная реакция;
> 0 – возможна только обратная реакция;
в) 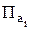 = К,
= К, 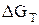 = 0 – в системе равновесие.
= 0 – в системе равновесие.
ПРИМЕР
Будет ли окисляться углерод, при Т = 1800К, если в стали [% С] = 0,25; {% О} = 30; {% CО} = 70; 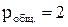 атм?
атм?
|
|
|
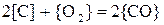 ,(расплав считать идеальным).
,(расплав считать идеальным).
Решение:
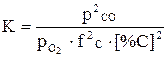 , т.к. раствор идеальный, ¦=1, следовательно
, т.к. раствор идеальный, ¦=1, следовательно
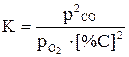
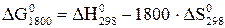
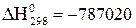 Дж,
Дж, 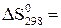 210,72 Дж/К.
210,72 Дж/К.
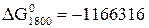 Дж
Дж
К = 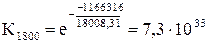 .
.
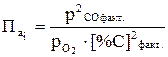
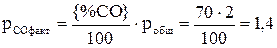 атм
атм
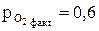 атм
атм
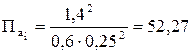 .
.
DGT = RT (ln 52,27 – ln7,3 × 1033)
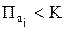 , следовательно, DGT < 0, углерод будет окисляться в стали при Т = 1800К при заданных фактических концентрациях.
, следовательно, DGT < 0, углерод будет окисляться в стали при Т = 1800К при заданных фактических концентрациях.
 2015-07-03
2015-07-03 1019
1019








