 За хімічною будовою піридин (азин) можна розглядати як аналог бензолу, в молекулі котрого група СН заміщена атомом азоту.
За хімічною будовою піридин (азин) можна розглядати як аналог бензолу, в молекулі котрого група СН заміщена атомом азоту.
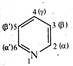
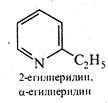
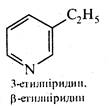
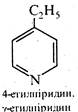
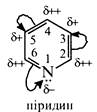
Для назв похідних піридину здійснюють нумерацію атомів циклу або використовують позначання грецькими літерами. Положення 2, 6 називають α, α', положення 3, 5 β, β', положення 4 – γ.
А. Способи добування
Піридин і його монометильні похідні α-, β- та γ-піколіни Містяться в невеликих кількостях у кам'яновугільній смолі (продукт сухої перегонки кам'яного вугілля), звідки їх виділяють в індивідуальному вигляді.
Крім того, існує велика кількість методів синтезу піридцну та його гомологів, найважливіші з яких ґрунтуються на реакції конденсації альдегідів з аміаком.
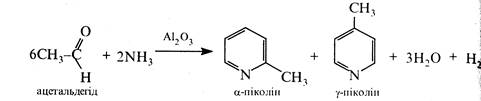
Так, з оцтового альдегіду і аміаку при 400 °С у присутності каталізатора А12О3 утворюється суміш, яка складається здебільшого з 2-та 4-метилпіридинів:
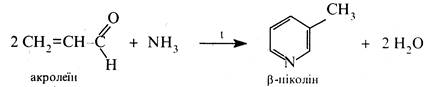
При нагріванні акролеїну з аміаком головним чином утворюєтьсі β-піколін:
Конденсацією ацетальдегіду та формальдегіду з аміаком добувають незаміщений піридин:
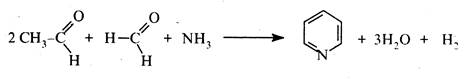
Використовуючи інші альдегіди та їх суміші, добувають різні алкіл піридини.
Б. Фізичні властивості
Піридин безбарвна рідина (т. кип. 115 °С) з характерним неприємним запахом. Змішується з водою, етанолом і більшістю opганічних розчинників.
В. Будова та хімічні властивості
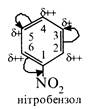
За будовою піридин схожий на бензол. Як і бензол, він є ароматичною сполукою, що містить циклічну 6π-електронну спряжену систему (див. розд. 3.1). Неподілена пара електронів піридинового атома азоту не бере участі в утворенні ароматичного секстету та зумовлює основні властивості сполуки. Проте на відміну від бензолу, в молекулі піридину електронна густина розподілена нерівномірно, що підтверджує порівняно великий дипольний момент (2,26Д). Внаслідок електроноакцепторного впливу атома азоту в піридиновому циклі на всіх вуглецевих атомах електронна густина зменшена, причому більшою мірою — в положеннях 2, 4 та 6 (α- та γ-положення), меншою — й положеннях 3 та 5 β-положення). Таким чином, піридин є π-дефіцитною ароматичною системою.
Вплив атома азоту на електронну густину піридинового ядра порівнянний зі впливом нітрогрупи на бензольне кільце в молекулі нітробензолу:
Характерні реакції піридину можна умовно поділити на три групи:
– реакції, що проходять за участю гетероатома;
– реакції заміщення атомів водню піридинового циклу;
– реакції відновлення та окиснення.
Реакції, що проходять за участю гетероатома.
1.Взаємодія з кислотами. Піридин є слабкою основою. Основність піридину (рКВН+ 5,25) близька до основності аніліну (рКВН+ 4,6). Водні розчини піридину забарвлюють червоний лакмусовий папір на синій колір. При взаємодії з сильними мінеральними та органічними кислотами, такими, як хлороводнева, бромоводнева, сірчана, пікринова та іншими, піридин дає піридинієві солі, які добре кристалізуються.
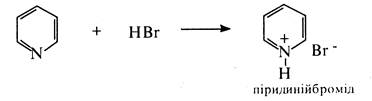
Утворення солі з пікриновою кислотою використовують для ідентифікації піридину.
2. Реакція з оксидом сірки (VI). За участю неподілених електронів атома азоту піридин порівняно легко реагує з триоксидом сірки, утворюючи донорно-акцепторний комплекс піридинсульфотриоксид:
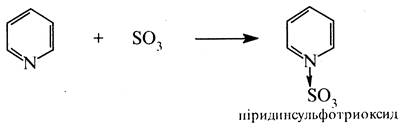
Піридинсульфотриоксид використовується в органічному синтезі як м'який сульфуючий реагент при сульфуванні ацидофобних гетероциклів.
3. Взаємодія з алкіл- і ацилгалогепідами.. При взаємодії з алкіл- і ацилгалогенідами піридин утворює четвертинні солі N-алкіл- і N-ацилпіридинію відповідно. У цих реакціях атом азоту молекули піридину виявляє нуклеофільні властивості, надаючи пару електронів для утворення зв'язку з електрофільним атомом вуглецю молекули галогеналкану або галогенангідриду карбонової кислоти.
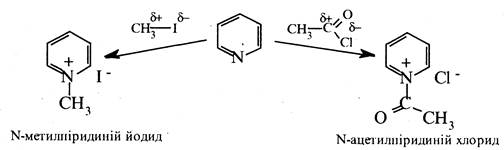
Солі N-ацилпіридинію характеризуються високою реакційною здатністю ацильного фрагмента у відношенні до нуклеофілів і тому є дуже ефективними ацилюючими реагентами.
 2015-07-14
2015-07-14 4052
4052








