Впіридиновому кільці можуть проходити реакції електрофільного та нуклеофільного заміщення.
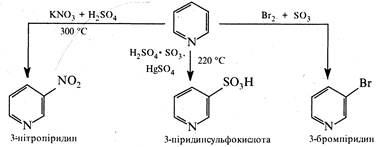
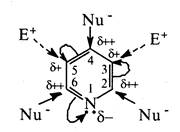 1. Реакції електрофільного заміщення в піридиновому циклі ідуть насилу. Нітрування, сульфування та галогенування піридину відбуваються тільки за жорстких умов. Так, нітрування проходить з низьким віходом при нагріванні піридину з нітратом калію в димлячій сірчаній кислоті; при 300 °С, сульфування відбувається при нагріванні з олеумом (220- 270 °С) в присутності каталізатора сульфату ртуті, бромування можливе при дії брому в олеумі. Електрофільний замісник спрямовується в β-положення циклу:
1. Реакції електрофільного заміщення в піридиновому циклі ідуть насилу. Нітрування, сульфування та галогенування піридину відбуваються тільки за жорстких умов. Так, нітрування проходить з низьким віходом при нагріванні піридину з нітратом калію в димлячій сірчаній кислоті; при 300 °С, сульфування відбувається при нагріванні з олеумом (220- 270 °С) в присутності каталізатора сульфату ртуті, бромування можливе при дії брому в олеумі. Електрофільний замісник спрямовується в β-положення циклу:
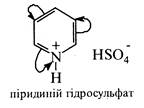
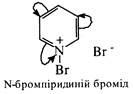
Реакції алкілування і ацилювання за Фріделем-Крафтсом для піридину не характерні. Низька реакційна здатність піридинового циклу в реакціях електрофільного заміщення та орієнтація заміщення в β-положення зумовлена електроноакцепторними властивостями атома азоту, котрий, зменшуючи електронну густину на всіх атомах вуглецю циклу, меншою мірою справляє вплив на β-положення, що і визначає місце атаки електрофільним реагентом. Крім того, в реакціях SE з протонними реагентами (нітрування, сульфування) піридин утворює по гетероатому солі піридинію, а з галогенами — донорно-акцепторні комплекси, в яких на атомі азоту з'являється позитивний заряд, а це, в свою чергу, призводить до ще більшої дезактивації піридинового циклу.
|
|
|
2. Реакції пуклеофільного заміщення через зменшення електронної густини на атомах вуглецю піридинового циклу полегшуються. На відміну від бензолу, піридин досить легко реагує з нуклеофільними реагентами, утворюючи продукти заміщення в положеннях 2, 4 або 6 (α- та β-положення).
З реакцій нуклеофільного заміщення найбільш відоме амінування за Чичибабіним. Воно основане на взаємодії піридину з амідом натрію (NaNH2) при нагріванні. Найкраще проходить амінування у середовищі рідкого аміаку. В результаті реакції утворюється 2-амінопіридин.
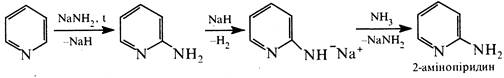
Дальше амінування веде до утворення 2,6-діамінопіридину. Заміщення на аміногрупу атома водню в γ-положенні відбувається тільки в тому разі, як α-положення вже зайняті.
Вперше цю реакцію здійснив у 1914 р. російський хімік-органік О.Є.Чичибабін і тому вона дістала назву реакції Чичибабіна. В дальшому її було розповсюджено на інші гетероциклічні сполуки.
Механізм реакції:
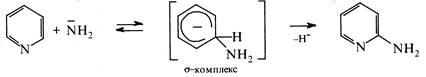
Реакція проходить за механізмом SN2. На першій стадії нуклеофільна частинка NH атакує піридинове кільце з утворенням σ-комплексу. Ha другій стадії σ-комплекс стабілізується шляхом відщеплення гідрид-іона (Н-).
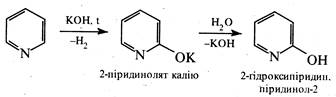
Аналогічно амінуванню відбувається гідроксилування піридинового циклу. При пропусканні парів піридину понад сухим гідроксидом калію при 300-320 °С утворюється 2-гідроксипіридин.
 2015-07-14
2015-07-14 2652
2652








