Расчет скорости электрохимической коррозии в теории микроэлементов основывается на том, что материальный эффект коррозионного процесса обусловлен протеканием электрического тока между анодными и катодными участками поверхности металла. В соответствии с этим выражение для скорости коррозии может быть получено посредством сочетания закона Ома и Фарадея. Пусть ∆Е означает разность потенциалов катода и анода, а R — полное омическое сопротивление коррозионного элемента. Сила тока, который протекает между катодом и анодом коррозионной пары, равна по закону Ома
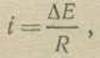 (1)
(1)
где ∆Е — разность потенциалов катода и анода коррозионной пары. Соответствующий этому току материальный расход металла на анодном участке пары
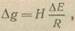 (2)
(2)
где Н — электрохимический эквивалент металла.
Следует иметь в виду, что если для расчета скорости коррозии в формулу (1) ввести значение начальной разности потенциалов коррозионной пары, то мы не получим правильного результата. В действительности скорость коррозии будет намного меньше, чем дает такой расчет.
|
|
|
Остановимся несколько подробнее на причинах этого явления. Пусть потенциал катода коррозионной пары в отсутствие приложенного тока будет равен Е0к, а потенциал анода пары при том же условии Е0а. Назовем величину Е0к – Е0а = ∆Е0 разностью потенциалов.
Величина ∆Е° всегда больше, чем ∆Е — разность потенциалов работающей пары. Действительно, потенциал катода при замыкании пары вследствие поляризационных изменений становится более отрицательным. В первом приближении зависимость потенциала катода от силы тока можно представить простым линейным выражением
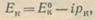 (3)
(3)
где рк означает поляризуемость катода и определяет наклон поляризационной кривой Е0кЕк (рис. 2). В свою очередь поляризационные изменения на анодных участках пары приводят к сдвигу потенциала анода:
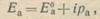 (4)
(4)
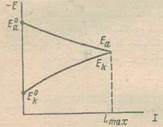
Рис.2. Диаграмма коррозионного процесса
где ра — анодная поляризуемость.
С учетом поляризационных изменений потенциалов катода и анода уравнение для силы тока коррозионного элемента примет вид
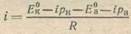 (5)
(5)
или
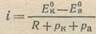 (6)
(6)
Полученная формула показывает, что поляризуемость анода и катода эквивалентна добавочному сопротивлению. Это сопротивление можно назвать поляризационным сопротивлением. Наличие последнего приводит к тому, что даже в отсутствие омического сопротивления [при R → 0] сила коррозионного тока не может стать бесконечно большой. Формула (6) показывает, что при этом
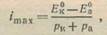 (7)
(7)
где imax представляет собой максимальную силу тока, какую способен дать замкнутый накоротко коррозионный элемент. Как видно из рис.2, потенциал катода при этом становится равным потенциалу анода и разность потенциалов понижается до нуля.
|
|
|
 2015-07-14
2015-07-14 1751
1751








