Скорость каждой конкретной молекулы газа все время меняется. Это обусловлено столкновениями молекул и происходящими в результате изменениями их энергии. Однако в каждый момент времени распределение молекул по скорости остается неизменным, если поддерживаются прежние условия. Ведь число молекул газа чрезвычайно велико!
Скорости молекул газа имеют самые разнообразные значения. Закономерность распределения частиц по скорости называется распределением Максвелла - Больцмана. На рис. 3.7 представлены графики распределения молекул по скорости при двух разных температурах. Следует обратить внимание, что при повышении температуры распределение становится более широким и в целом смещается в сторону более высоких скоростей.
Распределение Максвелла-Больцмана существует не только применительно к молекулярным скоростям, но и к молекулярным энергиям. Типичная кривая такого распределения молекулярных энергий показана на рис. 3.8.
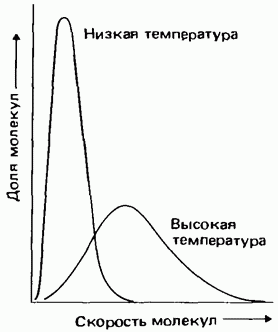
Рис. 3.7. Распределение молекул по скорости.
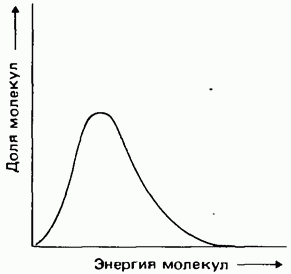
Рис. 3.8. Распределение молекул по энергии.
 2015-07-14
2015-07-14 1039
1039








