Федеральное государственное бюджетное учреждение науки
Институт неорганической химии им. А.В. Николаева
Сибирского отделения Российской академии наук
Реферат
Приближение Хартри, гамильтониан Хартри, волновая функция по Хартри, полная энергия системы, одноэлектронное уравнение Хартри.
Одинцов Данила Сергеевич
гр. 09402
Проверил:
д. ф.-м. н. Мазалов Лев Николаевич
Г. Новосибирск 2012г.
ОДНОЭЛЕКТРОННАЯ МОДЕЛЬ
Метод Хартри - приближенный метод нахождения волновых функций и энергетических состояний квантовой системы со многими электронами. В основе одноэлектронного приближения лежит предположение, что квантовую систему можно описать как систему отдельных электронов, движущихся в усредненном потенциальном поле, которое учитывает взаимодействие как с ядрами атомов, так и с другими электронами. Волновая функция многоэлектронных системы в одноэлектронном приближении выбирается в виде детерминанта Слейтера определенного набора функций, зависящих от координат одной частицы. Эти функции являются собственными функциями одноэлектронного гамильтониана с усредненным потенциалом.
Рассмотрим, как с помощью вариационного принципа можно найти волновые функции и уровни энергии неподвижного Н-электронного атома, максимально близкие к точным. Напомним, что волновая функция такого атома зависит от энергии межэлектронного взаимодействия, то есть требует учета мгновенных положений всех электронов, что является причиной затруднений при решении уравнения Шредингера.
H=TЭ(r) + Vэя(r) + Vээ(r)= −ћ/2m 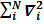 −
− 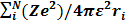 +
+ 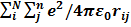 i<j (1)
i<j (1)
Поэтому вначале просто исключим из гамильтониана оператор энергии межэлектронного взаимодействия Vээ. В этом случае многоэлектронное уравнение Шредингера распадается на систему N одноэлектронных, то есть зависящих от координат только одного электрона, уравнений:
hiχi(ri)= 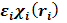 i= 1,2,3...N (2)
i= 1,2,3...N (2)
В каждом из одноэлектронных гамильтонианов
hi=(ћ2/2m)* 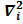 –(Ze2/4π
–(Ze2/4π 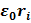 ) (3)
) (3)
первый член описывает кинетическую энергию электрона в i-м состоянии, а второй- потенциальную энергию его притяжения к ядру, тогда как Е; есть энергия электрона в i-м состоянии. В принятом приближении поведение каждого i-го электрона не зависит от поведения остальных электронов и описывается некоторой волновой функцией 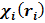 подобно единственному электрону в атоме водорода. В этом состоит суть приближения независимых частиц, которое носит довольно общий характер и используется в различных квантово-механических задачах. Применительно к многоэлектронным атомам оно известно как одноэлектронная модель. Решения
подобно единственному электрону в атоме водорода. В этом состоит суть приближения независимых частиц, которое носит довольно общий характер и используется в различных квантово-механических задачах. Применительно к многоэлектронным атомам оно известно как одноэлектронная модель. Решения 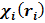 одноэлектронных уравнений (2) называются одноэлектронными волновыми функциями, или орбиталями. В атоме они носят название атомных орбиталей, в молекуле - молекулярных, в кристалле - кристаллических; энергии
одноэлектронных уравнений (2) называются одноэлектронными волновыми функциями, или орбиталями. В атоме они носят название атомных орбиталей, в молекуле - молекулярных, в кристалле - кристаллических; энергии 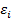 есть энергии соответствующих одноэлектронных состояний. Такой подход называют также орбитальным приближением. Полный гамильтониан атома в принятом приближении есть просто сумма одноэлектронных составляющих H=
есть энергии соответствующих одноэлектронных состояний. Такой подход называют также орбитальным приближением. Полный гамильтониан атома в принятом приближении есть просто сумма одноэлектронных составляющих H= 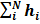 (4) i а энергия атома Е является суммой индивидуальных орбитальных энергий
(4) i а энергия атома Е является суммой индивидуальных орбитальных энергий
E= 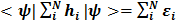 (5)
(5)
Поскольку электроны считаются независимыми, собственные функции атомного гамильтониана Н представляют собой произведение N атомных орбиталей, заселенных электронами
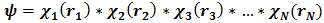 (6)
(6)
Приближенная многоэлектронная волновая функция вида (2.30) называется волновой функцией Хартри. Соответствующая функция распределения электронов в пространстве имеет вид
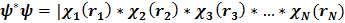 |2=
|2=
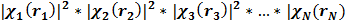 |2 (7)
|2 (7)
Структура функции распределения Хартри (7) такова, что вероятность найти i-й электрон в элементе объема dri вблизи точки ri равна, 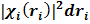 независимо от того, где находятся остальные (N- 1) электронов.
независимо от того, где находятся остальные (N- 1) электронов.
Гамильтониан (4) является, конечно, чрезмерно упрощенным. Во-первых, энергия межэлектронного отталкивания не мала, и пренебрегать ею нельзя. Во-вторых, эта энергия зависит от расстояний между парами всех электронов, причем, при изменении положения любого из электронов согласованно меняются расстояния, а значит и взаимодействия между всеми остальными электронами. Говорят, что существует корреляция в движении электронов, и для многоэлектронных систем учет этой корреляции является сложной и часто необходимой задачей. Например, игнорируя корреляцию, невозможно получить правильные оценки энергии диссоциации молекул, а следовательно и понять механизм этого явления.
 2015-07-21
2015-07-21 1482
1482







