Пример 1. Рассчитать энергетический эффект химической реакции в стандартных условиях: Al 2 O 3(к) + 3SO 3(г) → Al 2 (SO 4) 3(к). Известны энтальпии образования участвующих в реакции соединений:
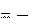 0
0
ΔH298,Al 2 (SO4)3
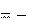 0
0
3434 кДж/моль;
ΔH298,Al 2O3
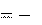
1675 кДж/моль;
395,2 кДж/моль.
Решение. Энтальпия этой реакции рассчитывается по формуле
ΔH0298,p-ции
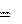 ΔH0298,Al
ΔH0298,Al
2 (SO4)3
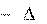 (H0298,Al
(H0298,Al
2O3
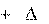
ΔH0298,p-ции
 3434
3434
 1675
1675
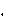
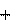 3 395,2
3 395,2
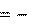 573,4 кДж.
573,4 кДж.
Энтальпия системы в ходе реакции уменьшается, в этом случае энергия выделяется, реакция экзотермическая.
Пример 2. Рассчитать энтальпию реакции
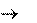 С2Н4(г) + Н2(г) С2Н6(г)
С2Н4(г) + Н2(г) С2Н6(г)
в стандартных условиях, зная энтальпии сгорания участвующих в реакции веществ:
ΔH0
298,сг.С2 Н 4
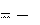 1411,3 кДж/моль;
1411,3 кДж/моль;
ΔH0 ΔH0
298,сг.Н 2
298,сг.С2 Н6
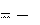 285,5 кДж/моль;
285,5 кДж/моль;
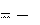 1560,2 кДж/моль.
1560,2 кДж/моль.
Энтальпии реакции можно рассчитать по формулам:
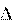
|
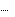 ции
ции
H0298,сг,исх.в-в
H0298,сг.продуктов;
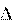
|
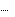 ции
ции
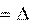
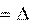
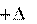
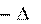
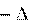
|
|
|
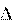 H0298,р
H0298,р
 ции
ции
 1411,3
1411,3
 285,5
285,5
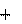 1560,2
1560,2
 136,6 кДж.
136,6 кДж.
Данная реакция экзотермическая.
Пример 3. Определить энтальпию образования метана, зная, что энтальпия реакции горения метана ΔН 0298,р = -804,75 кДж, а стандартные значения энтальпий образования СО 2 и Н 2 О равны соответственно  396кДж/моль и –241,8 кДж/моль.
396кДж/моль и –241,8 кДж/моль.
 Решение. СН 4(г) + 2О 2(г) СО 2(г) + 2Н 2 О (г)
Решение. СН 4(г) + 2О 2(г) СО 2(г) + 2Н 2 О (г)
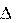 H0298,p
H0298,p
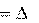
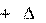 2 H0
2 H0
298,Н2O
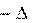
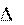
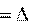
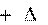
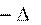 H0298,p
H0298,p 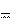
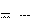 396
396
 2 241,8
2 241,8
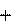 804,75
804,75
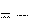 74,85 кДж / моль.
74,85 кДж / моль.
Пример 4. Какое количество тепла выделяется в ходе горения 10 г серы, если стандартное значение энтальпии образования SO 2 равно
-296,9 кДж/моль?
Решение. Уравнение химической реакции горения серы –
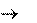 S + O 2 SO 2.
S + O 2 SO 2.
 Энтальпия этой реакции определяется по формуле
Энтальпия этой реакции определяется по формуле
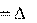
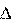 H 0298,p
H 0298,p
реакция экзотермическая.
H 0298,SO 2;
H 0298,p
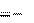 296,9 кДж,
296,9 кДж,
Определяем количество тепла, выделенное при горении 10 г серы.
Согласно уравнению реакции 1 моль дает 296,9 кДж тепла. Составляем пропорцию:
32 г S – 296,9 кДж, 10 г S – Х кДж;
Х = 10г ∙ 296,9кДж / 32г = 93кДж.
Пример 5. Вычислить тепловой эффект реакции получения гидроксида кальция из оксида кальция и воды, если стандартная энтальпия образования оксида кальция равна -635,7 кДж/моль, стандартная энтальпия образования воды равна -285,8 кДж/моль, а стандартная энтальпия образования гидроксида кальция равна -986,8 кДж/моль.
Решение.
Уравнение реакции получения негашеной извести из гашеной извести такое:
CaO + H2O = Ca(OH)2.
На основании первого следствия из закона Авогадро:
ΔH0 = ΔH0Ca(OH)2 – (Δ H0CaO + ΔH0H2O) =
–986,8 – (– 635,7 – 285,8) = – 65,3 кДж/моль.
|
|
|
Пример 6. Реакция окисления глюкозы в организме может протекать так:
С6Н12О6 (тв) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж),
D Н = –2803 кДж.
Какое количество теплоты выделится при окислении 800 г глюкозы?
Решение.
М (С6Н12О6) = 180 г/моль.
ν (С6Н12О6) = 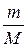 =
= 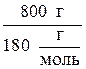 = 4,44 моль.
= 4,44 моль.
Δ H0 = ν (С6Н12О6) · Δ H = 4,44 · (–2803) = – 12458 кДж.
Задания для самоконтроля
1. Составьте термохимическое уравнение реакции разложения карбоната кальция, если при разложении 40 г карбоната кальция поглощается 70,8 кДж теплоты.
Ответ. CaCO3 = CaO + CO2  (г.) – 177 кДж/моль.
(г.) – 177 кДж/моль.
2. Сколько теплоты выделится при полном сгорании 1 м3 смеси, состоящей из 30% (по объему) этилена и 70% ацетилена, если при сгорании 1 моль этих веществ выделяется соответственно 1400 и 1305 кДж?
Ответ. 59 531 кДж.
3. Вычислите теплоту сгорания ацетилена С2Н2, если теплота образования углекислого газа 393,5 кДж/моль, водяного пара – 242 кДж/моль, ацетилена – 226,8 кДж/моль.
Ответ. 1604,4 кДж.
4. По термохимическому уравнению
N2 (г.) + О2 (г.) = 2NО (г.) – 180,7 кДж
вычислите, сколько поглотится теплоты при вступлении в реакцию 5,6 л азота (н. у.).
Ответ. 45,2кДж
5. При сжигании 3 г магния выделилось 75,15 кДж теплоты. Составьте термохимическое уравнение реакции горения магния.
Ответ. 2Mg + O2 = 2MgO + 1202кДж
6. По термохимическому уравнению реакции
2СО (г.) + О2 (г.) = 2СО2 (г.) + 566,5 кДж
вычислите теплоту сгорания оксида углерода(II).
Ответ. 283,25кДж/моль
7. При сжигании 93 г белого фосфора выделилось 2322 кДж теплоты. Рассчитайте теплоту образования оксида фосфора(V).
Ответ. 1548кДж/моль
8. Вычислите тепловой эффект реакции
Fe2O3 + 2Al  Al2O3 + 2Fe,
Al2O3 + 2Fe,
если теплота образования оксида железа(III) составляет +821,5 кДж/моль, а теплота образования оксида алюминия +1675,7 кДж/моль (теплота образования простого вещества равна нулю). Ответ. 854,2кДж/моль
 2015-07-21
2015-07-21 2471
2471






