Тольятти
ЛАБОРАТОРНАЯ РАБОТА № 38
ИЗУЧЕНИЕ СПЕКТРА АТОМА ВОДОРОДА
Цель работы: изучить спектр атома водорода в видимой области.
Приборы и принадлежности: малогабаритный универсальный монохроматор
МУМ-2, водородная трубка с трансформатором.
Задание для самостоятельной работы: проработать теоретический материал по темам: водородоподобные атомы, боровская модель атома водорода, энергетические уровни, постоянная Ридберга, спектры излучения водородоподобных атомов, формула Бальмера, пространственное распределение электрона в атоме водорода, используя учебные пособия:
1) Савельев И.В. В 3 т. Изд. 2-е. − М.: Наука, 1982. − Т. 2;
2) Трофимова Т.И. Изд. 5-е. − М.: Высшая школа, 1998.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
Оптический спектр – это распределение по частотам (или длинам волн) интенсивности оптического излучения рассматриваемого тела (спектр испускания) или интенсивности поглощения света при его прохождении через рассматриваемое вещество (спектр поглощения). Спектры атомов газов, находящихся при низком давлении, являются линейчатыми, т. е. состоят из отдельных линий.
|
|
|
Числа, определяющие возможные значения физических величин, характеризующих квантовые системы, называют квантовыми числами. Главное квантовое число 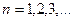 определяет возможные значения энергии атома водорода:
определяет возможные значения энергии атома водорода:
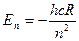 , (1)
, (1)
где 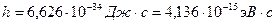 [*]-- постоянная Планка,
[*]-- постоянная Планка, 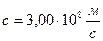 -- скорость света в вакууме,
-- скорость света в вакууме, 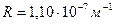 -- постоянная Ридберга.
-- постоянная Ридберга.
Орбитальное квантовое число 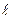 определяет возможные значения модуля орбитального момента импульса электрона:
определяет возможные значения модуля орбитального момента импульса электрона:
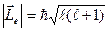 , (2)
, (2)
где 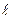 может принимать значения 0, 1, 2, 3, …,
может принимать значения 0, 1, 2, 3, …, 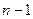 , а
, а 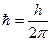 называется приведенной постоянной Планка.
называется приведенной постоянной Планка.
Магнитное квантовое число 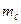 определяет возможные значения проекции орбитального момента импульса электрона на некоторое направление в пространстве (ось z):
определяет возможные значения проекции орбитального момента импульса электрона на некоторое направление в пространстве (ось z):
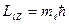 ,
,
где 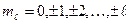 .
.
Спиновое магнитное квантовое число 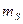 определяет возможные значения проекции спина (собственного момента импульса) электрона на фиксированное направление z:
определяет возможные значения проекции спина (собственного момента импульса) электрона на фиксированное направление z:
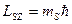 .
.
Спиновое магнитное квантовое число электрона может принимать только два значения: 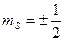 .
.
Из формулы (1) следует, что важнейшее свойство квантовой системы, состоящей из связанных частиц, заключается в том, что внутренняя энергия (т.е. энергия, не связанная с движением системы как целого) квантуется: она может принимать лишь определенные дискретные значения 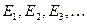 .
.
Таким свойством обладают, например, атомы и ионы, состоящие из (положительно заряженного) ядра и (отрицательно заряженных) электронов. Это резко отличает микроскопические (атомные, молекулярные, нано-размерные и др.) механические системы от классических, состоящих из макроскопических тел, в которых энергия, момент импульса и его проекции могут принимать любые значения из некоторого интервала. Соответственно, изменения этих физических величин в результате взаимодействия в классическом случае могут быть произвольно малыми. Энергия же атома может меняться лишь определенными порциями (квантами) 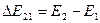 при переходе атома из одного энергетического состояния «1» в другое состояние «2».
при переходе атома из одного энергетического состояния «1» в другое состояние «2».
|
|
|
Возможные значения энергии 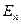 называются энергетическими уровнями, а набор значений энергии
называются энергетическими уровнями, а набор значений энергии 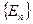 -- энергетическим спектром системы. Число частиц в единице объема, находящихся на данном энергетическом уровне, называется населенностью уровня.
-- энергетическим спектром системы. Число частиц в единице объема, находящихся на данном энергетическом уровне, называется населенностью уровня.
Состояние квантовой системы с минимально возможным значением энергии называется основным, или нормальным, а все остальные энергетические состояния – возбужденными. Формула (1) дает для энергии основного состояния атома водорода значение 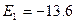 эВ[†]. Скачкообразный переход квантовой системы из одного состояния в другое называется квантовым переходом. Среднее число квантовых переходов данного типа за единицу времени, рассчитанное на одну частицу, называется вероятностью перехода.
эВ[†]. Скачкообразный переход квантовой системы из одного состояния в другое называется квантовым переходом. Среднее число квантовых переходов данного типа за единицу времени, рассчитанное на одну частицу, называется вероятностью перехода.
При переходе с более высокого уровня энергии 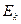 на более низкий
на более низкий 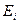 атом излучает фотон, при обратном переходе – поглощает его. По закону сохранения энергии
атом излучает фотон, при обратном переходе – поглощает его. По закону сохранения энергии
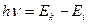 , (3)
, (3)
где 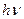 -- энергия фотона,
-- энергия фотона, 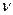 -- частота. Выражение (3) называется условием частот Бора.
-- частота. Выражение (3) называется условием частот Бора.
Формула Бальмера для частоты спектральной линии, испускаемой при переходе атома водорода из состояния с главным квантовым числом 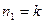 в состояние с главным квантовым числом
в состояние с главным квантовым числом 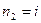 , получается из выражений (1) и (3):
, получается из выражений (1) и (3):
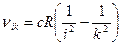 . (4)
. (4)
Все спектральные линии в спектре атома водорода могут быть объединены в серии – группы спектральных линий, возникающих при переходах с разных верхних уровней энергии на один и тот же конечный уровень. Каждой серии спектра атома водорода соответствует определенное значение главного квантового числа 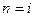 , задающего конечное состояние.
, задающего конечное состояние.
 2015-08-21
2015-08-21 263
263







