Цель работы: научиться определять рН водных растворов.
Задача: определить среду водных растворов электролитов с помощью кислотно-основных индикаторов.
Реактивы и оборудование: 1) 2н. растворы HCl, NaOH, 2) 0,5н. растворы KNO3, Na2CO3, Al2(SO4)3; 3) индикаторы: метилоранж; фенолфталеин; тимоловый синий; 4) штативы с пробирками; 5) химические стаканы на 50 мл.
Вода, являясь весьма слабым электролитом, в очень малой степени диссоциирует на ионы:
Н2О «Н+ + ОН-
Данный равновесный процесс описывается константой равновесия:
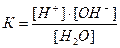 (1)
(1)
где К – константа диссоциации воды. При 220С она равна 1,8 ∙ 10-16.
Так как степень диссоциации воды очень мала, то в уравнении (1) концентрацию воды [Н2О] можно считать величиной постоянной
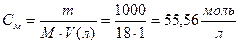 ,
,
тогда [H+]×[OH-] = K [H2O]=Kw, (2)
где Кw – ионное произведение воды.
Подставляя значения К и [Н2О] в уравнение (2), получим численное значение ионного произведения воды при 220С.
Kw = [H+][OH-] = 1,8 ∙ 10-16 ∙ 55,56 = 10-14
Зависимость КW от температуры демонстрируется следующими данными:
t, C0 10 22 30 50 100
КW 0,36 × 10-14 1,00 × 10-14 1,89 × 10-14 5,6 × 10-14 74 × 10-14
|
|
|
Таким образом, КW- величина постоянная лишь при данной температуре.
Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами. При 220С в нейтральных растворах концентрация как ионов водорода, так и гидроксид-ионов равна 10-7 моль/л. В кислых растворах больше концентрация ионов водорода, в щелочных – концентрация гидроксид-ионов. Но какова бы ни была реакция раствора, произведение концентраций ионов водорода и гидроксид – ионов остается постоянным.
Отсюда следует, что степень кислотности и степень основности раствора можно выразить с помощью концентраций ионов H+ или OH-:
Нейтральный раствор [H+] = 10-7 моль/л,
Кислый раствор [H+] > 10-7 моль/л,
Щелочной раствор [H+] < 10-7 моль/л.
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН.
Водородным показателем рН называют десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
рH = -lg[H+] или [Н+] = 10-рН (3)
где [Н+] - концентрация ионов водорода, моль/л.
Гидроксильным показателем рОН называют десятичный логарифм концентрации гидроксид-ионов, взятый с обратным знаком:
рОН = - lg [OH-] или [ОН-]=10-рОН (4)
где [ОН-] - концентрация гидроксид-ионов, моль/л.
Тогда рН + рОН=14; рОН=14 - рН. (5)
Наглядно зависимость между концентрацией ионов водорода, величиной рН и реакцией раствора можно выразить схемой
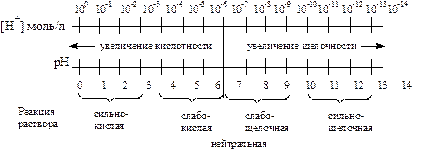
Из схемы видно, что чем меньше рН, тем больше концентрация ионов Н+, т.е. выше кислотность среды; и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е. выше щелочность среды.
|
|
|
Для измерения рН существуют различные методы. Приближенно реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода.
Кислотно-основные индикаторы (рН-индикаторы) – органические кислоты и основания, изменение окраски которых зависит от рН среды. (таблица 1).
Таблица 1 Переход окраски индикатора
| № | Индикатор | Интервал рН | Изменение окраски индикатора при возрастании рН |
| Лакмус | 5,0 – 8,0 | Красная ® фиолетовая ® синяя (розовая) | |
| Метилоранж | 3,1 – 4,4 | Красная (розовая) ® оранжево-желтая ® желтая | |
| Тимоловый синий | 1,2 – 2,8 8,0 – 9,6 | Красная ® желтая Желтая ® синяя | |
| Фенолфталеин | 8,0 – 9,6 | Бесцветная ® красная (малиновая) |
Значения рН некоторых наиболее известных растворов с указанием соответствующей им реакции среды: у желудочного сока рН 1,7 (сильнокислая реакция), у торфяной воды рН 4 (слабокислая), у дождевой воды рН 6 (слабокислая), у водопроводной воды рН 7,5 (слабощелочная), у крови рН 7,4 (слабощелочная), у слюны рН 6,9 (слабокислая), у слез рН 7 (нейтральная). Соки некоторых овощей и плодов имеют следующие значения рН:
Огурец 6,92 Щавель 3,74
Морковь «каротель» 6,67 Яблоки сорта
Столовая брюква 6,27 коричное 3,70
Розовый картофель 5,92 кавказский ранет 4,64
Редька.............. 5,32 антоновка 2,50
Качественное определение рН среды водных растворов электролитов выполните в соответствии с таблицей 2.
Ход работы 1) Для каждой системы приготовить по 3 пробирки (по числу индикаторов).
2) Так как более отчетливо переход окраски индикаторов происходит в разбавленных растворах, поэтому общий объем системы должен составлять» 10-12 капель: 6-8 капель дистиллированной воды плюс 1-2 капли для растворов кислот и щелочей и 4-6 капель для растворов солей.
3) Полученные результаты внесите в таблицу 2, укажите среду этих растворов.
Таблица 2. Определение среды водных растворов электролитов
| № п/п | Электролит | Цвет индикаторов | Среда раствора (слабокислая, сильнокислая, нейтральная, слабощелочная, сильнощелочная) | ||
| Метил- оранж | Фенол- фталеин | Тимоло- вый синий | |||
| Водопроводная вода | |||||
| Н2О дистил. | |||||
| HCl | |||||
| NaOH | |||||
| Na2CO3 | |||||
| KNO3 | |||||
| Al2(SO4)3 |
Литература.
1. Д.А. Князев, С.Н. Смарыгин. Неорганическая химия. – М.: Высшая школа, 2005.
2. Н.Л. Глинка. Общая химия. – М.: Интеграл – Пресс, 2001.
 2015-08-13
2015-08-13 1576
1576








