Активация г ядро к сильных и аминогрупп носителя. Под активацией матрицы понимают проведение химической реакции с активатором, в результате которой на ее поверхности образуются электрофильные группы, обладающие высокой реакционной способностью по отношению к нуклеофнльным группам на белке (например, аммно- и SH-группам). В числе наиболее эффективных электроф ильных групп можно назвать следующие (Дж. Порат, 1976):
имндокарбонйты
карбонаты
эпоксиды — СН—CHs
аэирндииы —СН—СНа
\ / NH
активированные двойные связи, напри- CHs=^CH—
мер —.О^СН— С (О)—
активированные атомы галогена, на- Вг—CHsr—С (О)—
гример Cl—G=NH
Реакции взаимодействия электрофилышх групп носителя с нуклеофильными группами белка будут рассмотрены в гл. III. Здесь остановимся на способах получения самих активированных полимерных матриц.
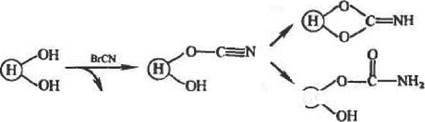
Имидокарбонаты. Получение этих производных основано иа реакции полимеров с циан галогена ми. Взаимодействие BrCN н водной или смешанной водно-органической среде с двумя соседними гндроксильными группами носителя приводит к образованию через неустойчивый цизнат активного имидокарбоната (I) и неактивного карбамата (II):
|
|
|
|
| н& (HI II |
Как правило, этот прием используется для активации полисахаридов. Синтетические полимеры активируют этим способом значительно реже.
При температуре ^20°С оптимальное значение рН этой реакции 11,0—12,5. Реакция в этих условиях крайне нерациональна. Дело в том, что создание сильно щелочной среды обусловлено необходимостью повышения нуклеофильности носителя, например полисахарида (за счет частичной ионизации ОН-группы). Однако здесь неустойчив как сам BrCN, так и образующийся эфир, который гидролизуется с образованием неактивного карбамата. Поэтому более 80% эфира циамата трансформируется по пути (II). Эффективность этой реакции можно повысить, увеличив электрофнльность циановой группировки. Такая возможность была реализована путем промежуточного переноса этой группировки на триэтнламин:
Ы(Е1)з + BrCN----- *~ N5SSC—N* <Е1)Э ВГ
@—ОН + NSaO-N* (El)jBr------ т- (Й)—О—O=3N
Реакция активации идет при рН 7—8 через образование очень реакционноспособного комплекса триэтиламмонийннтрнла (более реакционноспособного, чем BrCN), который атакует неиокизо-ванные ОН-группы полисахарида. При снижении рН с 12 до 7 в 20 раз снижается расход BrCN, вместо 4 включается до 24% от внесенного азота (причем 98% оказывается в составе активных групп матрицы вместо 10% по старой методике). Эффективность включения повышается до 50%, а токсичность снижается практически до нуля, если вместо BrCN использовать 1-циан-4-диметиламинопнридинтетрафторборат.
|
|
|
Эпоксиды (оксираны). Например, 1,4-бис (2,3-эпоксипро-покси)бутан часто используют для модификации и активации гидрокс ил содержат их полимеров;
| ,—СН— C |
ОН + СН,—СН—СНг—О—{СНг)4—О—СН,
СНаСН—СНа—О—(СН*)4—О—СНг—СН—СН,
Реакция протекает в щелочной среде (рН 8,5—11,0), реакционная способность образующегося эфнра в отношении нуклеофиль-
иых групп белков проявляется в обычном порядке: SH;> NH2 ;> ОН. Попутно может протекать реакция сшивки матрицы:
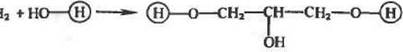
|
| <Н>—О—СН,—-сн—-р |
В результате матрица становится нерастворимой в кипящей воде и более устойчивой к кислотам.
Для получения эпоксиактнвированной матрицы вместо бис* оксирана можно употреблять эпихлоргндрин. Преимущество носителей, эпоксидированных длинноцепочечными соединениями типа диглицилового эфира 1,4-«-бутандиола, по сравнению с носителями, обработанными эпихлоргидрином, и в целом преимущества метода эпоксидирования перед другими, в частности, бромцнановым, заключаются в том, что он дает возможность получать длинную «иожку», отделяющую фермент от носителя. Это обстоятельство может иметь значение для уменьшения потери ферментативной активности из-за стерических затруднений, возникающих в процессе иммобилизации.
Соединения с активированными двойными связями- В полимеры, содержащие гидроксильиые или аминогруппы, можно ввести винилсульфонильные группы. Для этого матрицу обрабатывают дивннилсульфоном в сильнощелочной среде:
-CHj—СНа—SO3—CH=CH,
Этот метод активации используется редко ввиду токсичности днвинилсульфона.
Весьма аффективными агентами для активации полисахаридов оказались ароматические хиноны, в частности бензохинон:
О
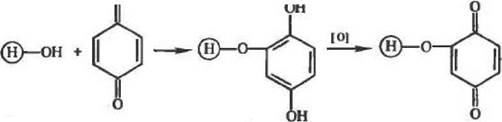
Реакция протекает легко с высоким выходом, в широком интервале рН (от 3 до 10).
Соединения с активным атомом галогена, Хлортриазины (на пример, цианурхлорид) легко реагирует с гидроксильной и ами ногруппой полимера в щелочной водно-орган и чес кой среде:
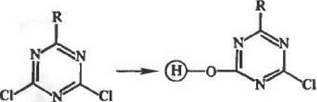
|
(где R = ^CJ; —NH2; —NHR')
Наиболее часто этим способом активируют полисахариды и их аминопроизводные, хотя используются и белковые носители (коллаген, кератинт фиброин). Среди синтетических полимеров амннированный полистирол и поливиниловый спирт также могут быть успешно активированы хлортрназинами.
Эффектнвным реагентом, позволяющим проводить реакцию в мягких условиях (рН 7,5) t является трезилклорид (трифтор-этил сульфон ил хлорид):
:Н3ОН *■ С1—SOj—CHa—
I,—О— Юг —СНД—CF3 + НС1
Альдегидные группы. Введение реакцноннослособных альдегидных групп может быть осуществлено несколькими путями. Полимеры, имеющие гидрокскльные группы, например полисахариды, могут быть окислены под действием периодата натрия. В качестве примера можно привести структуру эвена диалъде-гидцел л юл оэ ы:
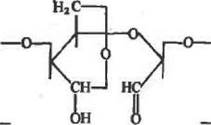
п
Применение альдегидных производных полисахаридов часто обеспечивает меньшую потерю активности фермента, чем, например, хлортриазильных производных.
Введение альдегидных групп в полимеры, содержащие аминогруппы, можно проводить с помощью диальдегидов, например глутарового альдегида. Таким способом можно активировать аминоэтилцеллюлозу, амннополистнрол, ПААГ, полиамиды, белковые носители и т, д. Реакцию активации аминогрупп можно представить так:
-NHa + НОС—(CHi)s—CHO
_N=CH—(ГИа)3—СНО
И наконец, введение альдегидной группы можно осуществить при полимеризации, подбирая соответствующий мономер, например аддукты полиакролеина и гидросульфита натрия, сополимеры ненасыщенных альдегидов и вин ил пиррол ид она и т. д. Один из процессов разобран выше (получение ваиакрила).
Имидоэфирные группы ( —C = NH—). Введение этих групп
I OR
применяется как один из способов активации полиамидных носителей. Схему реакции с диметилсульфатом можно представить следующим образом:
|
|
|
.10
—С—NH----- 1£У&^ — C=NH—
I 1
О ОСНэ
Полимерные нитрилы обработкой хлор водородом в среде метанола также можно активировать до имидопроизводных:
—НгС—СН
I
EN
net.
I
C=NH
I OCR,
Диазогруппы ( —N^NCI). Их введение—весьма широко применяемый способ активации носителей, содержащих аминогруппы в ароматических радикалах. В качестве примера можно назвать л-аминобензилцел.пюлозу, поли -rt-аминости рол, наиболее часто активируемые этим путем. К амннопроиэводным также относятся ароматические амннолронзводные шелка, шерсти, хитина, частично гидролизе ванный полиамид и др.
Довольно сложная схема активации сефарозы с целью введения peaкционнеспособных диазогрупл предложена С. Икедой и С. Фукуи (1973):
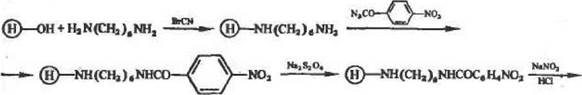
|
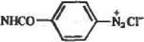
|
| ®—nhccjw. |
Аминогруппы, Введение этих групп (с последующим диазотнро-ванием) в носители, содержащие ОН-группы, может осуществляться различными способами. Полисахариды, как правило» обрабатывают хлоран гидридом л-нитробензойнон кислоты, далее NOs-rpynnu восстанавливают до NHs-rpynn:
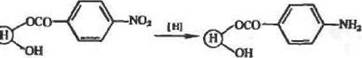
|
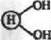
|
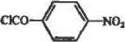
|
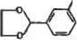
ОН-группы поливинилового спирта активируют взанмодейст-»м с 2-(ж-ами|юфенил)-!,3~диоксоланом (а) или я-нитрофе нилхлорметаиом (б):
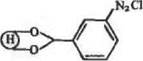
|
кн.
|
IK]
)Н
Активация карбоксильных групп носителя. Введение азидной группы — это один из наиболее старых способов активации носителей. Чаще всего для этой цели используют карбоксильные производные полисахаридов — целлюлозы, декстрана. Модифи цированный препарат этернфицнруют, переводят в гидразид, а затем в азид:
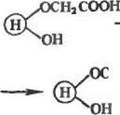
|
| H,CONHNHj |
С)Н|Ш
В качестве источника для получения азида можно применять и полимеры, не имеющие карбоксильных групп. Например, поли-акриламид, обработанный гидразином («энзакрил АН»), легко превращается в азид непосредственно перед иммобилизацией фермента:
@— CONHj -™'™U. @—CONHNH,------------- *- @—CONj
В последнее время азидный метод применяется редко из-за одновременного протекания ряда побочных реакций, приводящих к образованию неактивных амидных и карбамндных групп на носителе.
|
|
|
Широкое распространение получил метод ацклирования в присутствии карбодиимидов. В качестве карбоксилсодержащих полимеров могут быть использованы производные полисахаридов, различные полимеры на основе акриловой кислоты, сополимеры N-винил пи рролидона и ненасыщенных кислот и др.:
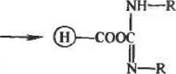
|
г*
(н)—соон+с
П—R
И наконец, весьма эффективным методом активации носителей, содержащих карбоксильные группы, является ацилирова-ние, в присутствии реактива Вудворда (1Ч-этил-5-фенилоксазо-лий-З'-сульфоната):
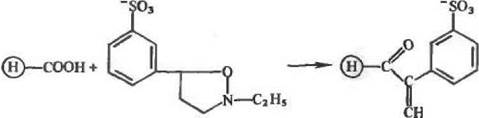
|
| _м |
Этот процесс характеризуется такими положительными качествами, как быстрота, мягкие условия протекания и, что очень важно, возможностью легко контролировать количество введенных активированных групп.
Модификация амидных групп (на примере полнакриламида). Как правило, первая стадия активации полимера, содержащего амидную группу, -^ это проведение реакции переамндирования:
f ° ЖШт
I 4NHa I JO
Не—cr
Образовавшаяся функциональная группа требует дополнительного активирования. Оно может быть проведено различными путями. Один из них — формирование стабильного диокси-производного с последующим окислением до альдегида непосредственно перед взаимодействием с ферментом:
 t. Щ,-" СН—СГ
t. Щ,-" СН—СГ
И— (CHiV-NHi х *шш* 4NH—(СНа)!— NHCHjCH
ОМ
(к)
XNH—(CHj)^ NHCBj
Другой путь последующей активации полнакриламида — это введение дназогруппы:
'-Wlh ш (g)—CONHfCH,)*—NHCO—QH<-NOi-^—
(H)—COWH(CHt)t—NHCO—CfitU—
---- *- (g)—CONH<CH2>4—NHCO—C«H*—H^SNCl
Модификация бензольного ядрй (иа примере полистирола). Наиболее распространенными из реакций модификации поли-стирплы1ых матриц являются хлорметилирование и нитрование. Хлорметилирование может быть проведено различными способа-ми^ например под действием монохлордиметилового эфира в присутствии SnCU:
I I
|
|
Хлорметильное производное может быть промодифицировано дальше избытком амина по отношению к хлорметильным группам (для предотвращения сшивания полистирольных цепей):
|
| HsNHR |
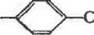 1
1
НаС НС
Nal
I
HsC НС
(R =—<CH3)2NHa: —(CH4»aNH(CH*)2NH2)
Схема процесса нитрования с последующим восстановлени ем нитрогруппы может быть представлена так:
HsC HaC НаС
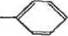
|
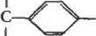
|
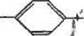
|
Н,с
|
| N=N(C|) |
Кроме этих* наиболее известных способов модификации бензольного ядра полимера используют также методы, основанные на введении альдегидных к карбоксильных групп:
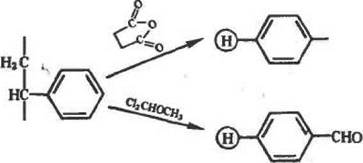
|
| СО(СН»),СООН |
 2015-08-13
2015-08-13 1589
1589








