При погружении в воду электродов и подводе к ним достаточного напряжения начинается процесс переноса электрического тока движущимися к электродам ионами в электролите, которым является вода, и электронами во внешней цепи. Под действием электрического поля, положительно заряженные ионы мигрируют к катоду, а отрицательно заряженные ионы — к аноду. На электродах происходит переход электронов. Катод отдает электроны в раствор и в приэлектродном пространстве происходят процессы восстановления. В прианодном пространстве протекают процессы переноса электронов от реагирующих частиц к электроду — окисление.
Устройства, в которых проводят те или иные процессы электрохимического воздействия на водные растворы, имеют общее название — электролизеры. В зависимости от природы процессов, протекающих в таких аппаратах и обеспечивающих извлечение или обезвреживание загрязняющих компонентов, они подразделяются на анодное окисление и катодное восстановление, электрокоагуляцию, электрофлотацию, электродиализ.
|
|
|
Электрохимические методы позволяют извлекать из воды ценные продукты при относительно простой автоматизированной технологической схеме очистки, без использования химических реагентов. Процесс можно проводить периодически и непрерывно. Недостатки методов — большой расход электроэнергии и металла, загрязнение поверхности электродов, что требует их очистки.
В процессе электрохимической очистки токсичные вещества могут превращаться в нетоксичные или малотоксичные соединения, переходить в газообразное состояние, выпадать в осадок, флотироваться в виде пены, осаждаться на катодах (металлические осадки).
Методом электролиза можно удалять из сточных вод соли, кислоты и щелочи с одновременной их регенерацией. Электрохимические методы очистки сточных вод различных производств (от цианидов, роданидов, нитросоединений, аминов, спиртов, альдегидов, сульфидов, меркаптанов, красителей и др.) основаны на анодном окисле-нии указанных веществ. Катодное извлечение металлической меди применяют на предприятиях цветной металлургии, металлообработки, химической промышленности.
При электролизе сточных вод на катоде выделяется газообразный водород и разряжаются растворенные в воде ионы металлов. На аноде из веществ, не подвергающихся электролитическому растворению, выделяются кислород и галогены, окисляется некоторые присутствующие в сточных водах ионы и молекулы с образованием других ионов и молекул.
Аноды из железа, алюминия к некоторых других металлов под действием постоянного электрического тока растворяются с образованием нерастворимых в воде оксигидратов или основных солей соответствующих металлов, способных к коагуляции.
|
|
|
Эффект очистки электрохимическими методами зависит от исходных свойств сточной воды (рН, температуры, общего содержания солей), а также от применяемых материалов для электродов и расстояния между ними, плотности тока, расхода электроэнергии, наличии диафрагм и их материала, а также интенсивности массообмена (перемешивания) в процессе электролиза.
Применение электрохимических методов целесообразно при относительно высокой электропроводности сточных вод, обусловленной наличием в них неорганических кислот, щелочей или солей (при минимальной концентрации солей, равной 0,5 г/л).
Общая принципиальная схема электролизера представлена на рисунке 46.
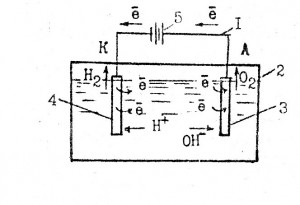
Рисунок 46 – Схема электролизера
1 – внешняя цепь; 2 – емкость; 3 – анод; 4 – катод; 5 – источник питания.
 2015-08-13
2015-08-13 1110
1110








