Відомо, що всі матеріальні тіла складаються з атомів та молекул, які перебувають у стані безперервного руху і взаємодіють між собою. Атоми і молекули, як структурні елементи речовини, можна описати різними моделями залежно від обставин і характеру явищ, що відбуваються в речовині. В одних випадках їх уявляють матеріальними точками, в інших – абсолютно твердими тілами, а ще в інших беруть до уваги їхню внутрішню структуру. Будову атомів і молекул вивчає квантова механіка, тому закономірності структури і взаємодії молекул можна вважати відомими.
У молекулярній фізиці моделлю речовини є сукупність атомів і молекул, закономірності руху і взаємодії яких відомі.
Масу атомів і молекул у молекулярній фізиці описують не абсолютними значеннями, а відносною безрозмірною величиною, яку називають відносною атомною Аr , або відносною молекулярною масою Мr. За одиницю атомної маси приймають 1/12 маси ізотопу вуглецю 12С:
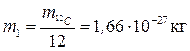 (1.1)
(1.1)
Відносну молекулярну (атомну) масу визначають за формулою
|
|
|
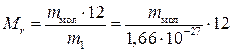 , (1.2)
, (1.2)
де m мол – абсолютна маса молекули (атома), кг.
Кількість речовини в системі одиниць СІ виражають у молях. Один моль – це така кількість речовини, яка містить у собі стільки ж структурних елементів, скільки їх міститься в 0,012 кг ізотопу вуглецю 12С. Один моль будь-якої речовини завжди містить однакову кількість структурних елементів (закон Авогадро). Цю кількість виражає число Авогадро
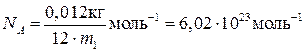 .
.
У молекулярній фізиці користуються також поняттям молярної маси, тобто маси одного моля речовини:
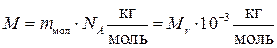 , (1.3)
, (1.3)
де m мол – маса молекули, Mr – відносна молекулярна маса.
Кількість молів речовини 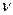 пов’язане з кількістю її молекул N або ж з її масою m таким співвідношенням:
пов’язане з кількістю її молекул N або ж з її масою m таким співвідношенням:
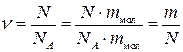 , (1.4)
, (1.4)
де М – молярна маса.
 2015-08-21
2015-08-21 543
543








