Скорость хим. реакции в гомогенных системах наз. Количество вещества прореагировавших в единицу времени на единицу объема. V= C0-C1/T1-T0; В 1867 г. голландцы К. Гульдберг и П. Вааге установили характер этой зависимости и открыли основной закон химической кинетики – закон действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению мгновенных концентраций, возведенных в степени их стехиометрических коэффициентов.
При этом стехиометрические коэффициенты должны отражать механизм элементарных актов реакции.
Кинетическое уравнение, отражающее механизм взаимодействия, может быть получено только в результате экспериментального изучения реакций и не всегда совпадает с суммарным стехиометрическим уравнением.
Для реакции в общем виде:
 ,
,
формальное условное кинетическое уравнение прямой реакции 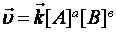 , обратной –
, обратной – 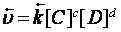 .
.
Вид кинетического уравнения зависит от порядка реакции.
В общем случае постулат химической кинетики для реакции можно выразить в общем виде как 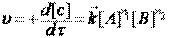 , где коэффициенты n1, n2определяют порядок реакции по данному компоненту (коэффициенты n могут быть целочисленными, дробными или равными нулю.
, где коэффициенты n1, n2определяют порядок реакции по данному компоненту (коэффициенты n могут быть целочисленными, дробными или равными нулю.
К – это коэфиц. Пропорциональности реакции, константа скорости реакции, удельная скорость реакции СА=СВ=1 V=K К- зависит от природы реагирующих веществ, температуры, катализатора и от его количества, и даже от выбора единиц времени и единиц концентрации. Не зависит от концентрации реагирующих веществ.
Кинетическая классификация хим. реакции. 1) по числу реагирующих частиц (молекулярность и порядок). 2) по природе реагирующих веществ. (Молекулярная – реагируют молекулы между собой, ионные – реагируют ионы, радикальные – радикалы.) 3)по числу фаз. (Гомогенные – одна фаза. Гетерогенные – в разных фазах.) 4) по кинетической обратимости.(Необратимые односторонние, обратимые – 2 сторонние.) По количеству: молекулярность – если в реакции принимает 1 молекула то мономолекулярная А переходит в В. А= В+Д; V=-Dc/dt. V=kc. Бимолекулярные – когда в реакции принимают 2 малекулы.2А=В+С. V=-Dc/dt. V=kc2. Трёхмолекулярные 3А=В+С+Е. V=-Dc/dt. V=kc3 В отличии от молекулярности порядок реакции опред. По уравнению выражающего зависимость скорости реакции от концентрации реагирующих веществ и равен сумме показателей степеней при концентрации в этом уравнении. Для реакции первого порядка скорость V=-dc/dt. V=kc. K= 1/t *lnC0/C. Можно определить полупериод реакции время в течении которого реагирует половина исходного вещества t1/2=ln2/k. Для реакции второго порядка скорость V=-dc/dt. V=kc2. K= 1/t *(1/C - 1/C0). Полупериод реакции зависит от концентрации исходного вещества t1/2=1/kС0.(второго порядка). если реакция не чем не осложнена то это будет реакция 2 го порядка.
Общий метод определения порядка реакции основан на законе действующих масс:
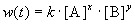 . (3.1)
. (3.1)
Представим, что вещество B находится в большом избытке, и его концентрация мало меняется в ходе реакции. Тогда порядок реакции по веществу A можно определить, измерив скорость реакции при двух концентрациях A. Записывая уравнение (3.1) для двух моментов времени в логарифмической форме и вычитая одно выражение из другого, найдем порядок x:
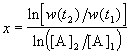 . В случае, если имеется больше двух экспериментальных точек, можно записать кинетические данные в координатах lnw - ln[A] и представить их в линейном виде с помощью метода наименьших квадратов. Тогда порядок реакции x будет равен тангенсу угла наклона прямой.
. В случае, если имеется больше двух экспериментальных точек, можно записать кинетические данные в координатах lnw - ln[A] и представить их в линейном виде с помощью метода наименьших квадратов. Тогда порядок реакции x будет равен тангенсу угла наклона прямой.
Если реакция имеет целый порядок, то для определения порядка используют различные частные методы. Метод подстановки заключается в том, что кинетические данные представляют в виде
kt = f([A]),
где функция f соответствует решению кинетического уравнения для одного из целых порядков. Если величина k, определенная таким образом, будет постоянной, то мы угадали, т.е. выбрали верный порядок. Если k будет изменяться со временем, то надо выбрать функцию f, соответствующую другому порядку.
Другой способ определения целого порядка заключается в измерении зависимости времени протекания реакции от начальной концентрации. Измеряя время превращения t x при двух начальных концентрациях, можно определить порядок n по формуле: 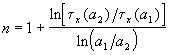 .
.
 2015-08-12
2015-08-12 839
839








