Как уже отмечалось, одним из постулатов статистической физики является утверждение о существовании термодинамического (статистического) равновесия. Считается, что система, находящаяся при определенных неизменных внешних условиях (при постоянных значениях внешних параметров и постоянной температуре окружающих тел), с течением времени рано или поздно придет к состоянию равновесия. Всякая система, выведенная из состояния термодинамического равновесия, самопроизвольно возвращается в него. Процесс возвращения системы в состояние равновесия носит название релаксации, а время перехода к равновесию – времени релаксации.
Возвращение системы в равновесное состояние происходит с конечной скоростью, а значит, и с конечным временем, которые зависят не только от термодинамических параметров системы (давления, температуры и т. п.), но и от ее микроскопических характеристик, в частности, от величин, характеризующих взаимодействие между частицами. Такими характеристиками могут служить средняя длина свободного пробега молекул 𝜆 и среднее время свободного пробега 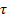 .
.
|
|
|
Во многих случаях скорость изменения некоторого параметра x при стремлении системы к равновесному состоянию можно считать пропорциональной отклонению этого параметра от равновесного значения x 0, т.е.
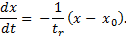
Решение этого уравнения имеет вид
x (t) - 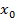 = C exp(–
= C exp(– 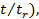
где C – постоянная интегрирования. Время tr, за которое величина 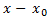 уменьшается в e раз, представляет собой время релаксации, соответствующее данному параметру x. Оно является важной характеристикой неравновесной системы, показывающей, как долго система находится в таком состоянии. Поскольку многие процессы (в том числе химические реакции, поглощение и излучение света и др.) протекают в неравновесных системах не так, как в равновесных, то знание времени релаксации оказывается весьма существенным для понимания процессов, происходящих в данной системе.
уменьшается в e раз, представляет собой время релаксации, соответствующее данному параметру x. Оно является важной характеристикой неравновесной системы, показывающей, как долго система находится в таком состоянии. Поскольку многие процессы (в том числе химические реакции, поглощение и излучение света и др.) протекают в неравновесных системах не так, как в равновесных, то знание времени релаксации оказывается весьма существенным для понимания процессов, происходящих в данной системе.
Как правило, длина свободного пробега и среднее время между двумя последовательными соударениями частиц значительно меньше размера системы и времен, в течение которых протекают в ней макроскопические процессы. Поэтому равновесие в системе устанавливается в два этапа. Вначале оно устанавливается лишь в микроскопически малых областях системы, которые, однако, содержат все же огромное число молекул. Поскольку взаимодействие каждой такой части системы с другими, подобными ей частями, происходят в основном по поверхностям раздела, их можно считать почти изолированными подсистемами со своими температурой, давлением, скоростью процессов и т.д. В каждой подсистеме равновесие устанавливается очень быстро с временем релаксации, приблизительно равным среднему времени свободного пробега молекул.
|
|
|
На втором этапе происходит выравнивание температуры, давления и т. п. всех описанных выше подсистем. Эти процессы протекают медленно, т.е. с большим временем релаксации, много большим среднего времени свободного пробега. Разделение процессов релаксации на быструю и медленную части возможно, конечно, лишь при условии, что размеры системы значительно больше средней длины свободного пробега молекул.
Равновесное состояние газа в молекулярно-кинетической теории рассматривается как состояние полной хаотичности движения молекул. Любое неравновесное состояние газа всегда связано с нарушением полной хаотичности. Основной особенностью неравновесных состояний является стремление газа, как и любой термодинамической системы, самопроизвольно переходить к равновесному состоянию. Это обусловлено хаотическим тепловым движением молекул, при котором происходит их перемещение из одной части газового объема в другие, столкновением их друг с другом и со стенками сосуда, изменением величины и направления скорости движения. Происходит постоянное перемешивание молекул и передача ими при столкновениях импульса и энергии друг другу. Это приводит к постепенному сглаживанию всяких различий между частями газа. С течением времени в газе, находящемся в неподвижном сосуде, плотность во всех точках объема газа выровняется и давление во всех точках примет определенное значение, зависящее только от температуры. В конце концов, установится такое состояние, когда все процессы прекратятся – это и будет состояние равновесия. Процессы установления равновесия в газе протекают очень быстро – в течение нескольких значений среднего времени свободного пробега молекул 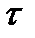 .
.
Установление в газе равновесного состояния всегда связано с направленным переносом массы, энергии и импульса. Процессы переноса массы, энергии и импульса в газе называют явлениями переноса. В каждом конкретном случае явления переноса определяются теми отклонениями от равновесного состояния, которые имеют место в данном неравновесном состоянии. К явлениям переноса относят диффузию, теплопроводность и внутреннее трение, или вязкость. Диффузия обусловлена переносом массы, теплопроводность – кинетической энергии и вязкость – импульса молекулы.
Прежде чем перейти к описанию этих процессов, введем два важнейших понятия, определяющих указанные явления переноса, – это понятия потока и плотности потока. Определим поток какой-либо величины G как количество этой величины, переносимое за единицу времени через некоторую площадку, расположенную перпендикулярно направлению переноса, т.е. как 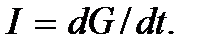 Отношение потока к площади
Отношение потока к площади 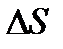 площадки, через которую переносится величина G, т.е. величину
площадки, через которую переносится величина G, т.е. величину 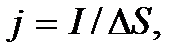 называется плотностью потока. Плотность потока определяет количество величины G, переносимое за единицу времени через единичную площадку, расположенную перпендикулярно направлению переноса. При небольших отклонениях системы от равновесного состояния потоки прямо пропорциональны градиентам величин, создающим эти отклонения от равновесия. Такими градиентами являются, например, градиенты концентрации, температуры и др. Их называют термодинамическими силами и обозначают X. Вблизи равновесия потоки линейно зависят от термодинамических сил: I ~ X.
называется плотностью потока. Плотность потока определяет количество величины G, переносимое за единицу времени через единичную площадку, расположенную перпендикулярно направлению переноса. При небольших отклонениях системы от равновесного состояния потоки прямо пропорциональны градиентам величин, создающим эти отклонения от равновесия. Такими градиентами являются, например, градиенты концентрации, температуры и др. Их называют термодинамическими силами и обозначают X. Вблизи равновесия потоки линейно зависят от термодинамических сил: I ~ X.
Рассмотрим теперь процессы, приводящие к установлению равновесия в газе.
 2015-09-06
2015-09-06 1373
1373








