Рівняння (8.10) та (8.11) є рівняннями третьої степені відносно об’єму. При заданих значеннях температури та тиску рівняння має три корені: або всі три дійсні, що має місце при низьких температурах, або ж один дійсний і два комплексно-спряжені, що спостерігається при високих температурах. Фізичний зміст мають лише дійсні корені.
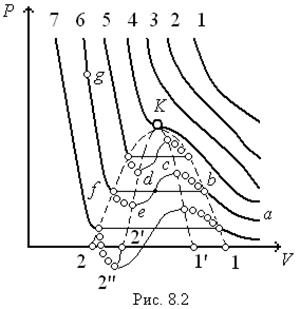 При високих температурах ізотерми реального газу, отримані на підставі рівняння Ван-дер-Ваальса, відрізня-ються від ізотерм ідеального газу лише деяким викривленням їх форми (рис. 8.2).
При високих температурах ізотерми реального газу, отримані на підставі рівняння Ван-дер-Ваальса, відрізня-ються від ізотерм ідеального газу лише деяким викривленням їх форми (рис. 8.2).
При низьких температурах, вони суттєво відрізняються, маючи макси-мум та мінімум.
Для приведених на (рис. 8.2) ізотерм температури 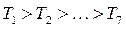 .
.
Проаналізуємо низькотемпературну ізотерму 6. Ділянка 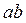 відповідає зви-чайному стисканню газу: суттєве змен-шення об’єму призводить до не дуже значного збільшення тиску. Якщо в подальшому (після точки
відповідає зви-чайному стисканню газу: суттєве змен-шення об’єму призводить до не дуже значного збільшення тиску. Якщо в подальшому (після точки 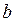 ) процес стискання виконувати нескінченно помалу (рівноважний процес), то ізотерма буде продовжуватися по ділянці
) процес стискання виконувати нескінченно помалу (рівноважний процес), то ізотерма буде продовжуватися по ділянці 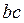 . Якщо стискання проводити швидко (не рівноважний процес), то ізотерма буде продовжуватися по прямій
. Якщо стискання проводити швидко (не рівноважний процес), то ізотерма буде продовжуватися по прямій 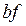 : зменшення об’єму не призводить до підвищення тиску. Таке становище можливе, якщо поруч з газом є речовина з меншим питомим об’ємом. Досвід свідчить, що при стисканні газу в межах низьких температур відбувається його поступове зрідження, тобто ділянка ізотерми
: зменшення об’єму не призводить до підвищення тиску. Таке становище можливе, якщо поруч з газом є речовина з меншим питомим об’ємом. Досвід свідчить, що при стисканні газу в межах низьких температур відбувається його поступове зрідження, тобто ділянка ізотерми 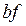 відповідає двофазному стану речовини: газ-рідина. На ділянці
відповідає двофазному стану речовини: газ-рідина. На ділянці  незначному зменшенню об’єму відповідає різке збільшення тиску, що є характерним для рідин.
незначному зменшенню об’єму відповідає різке збільшення тиску, що є характерним для рідин.
|
|
|
 При дуже повільному розширенні газу від точки
При дуже повільному розширенні газу від точки 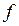 ізотерма проводиться по кривій
ізотерма проводиться по кривій 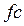 . Ділянка
. Ділянка 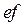 відповідає перегрітій рідині, а ділянка
відповідає перегрітій рідині, а ділянка 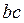 – переохолодженій парі. Обидва ці стани речовини є метастабільними.
– переохолодженій парі. Обидва ці стани речовини є метастабільними.
Точка 2΄ з від’ємним тиском відпо-відає метастабільному стану “розтяг-нутої” рідини. Такого стану можна до-сягти, запаявши малу сферичну посуди-ну з рідиною, що змочує стінки посуди-ни, при підвищеній температурі, а потім потроху остудити її.
Ділянка 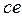 відповідала б непри-родному положенню, коли стискання речовини призводило б до зменшення тиску, а останнє в свою чергу викли-кало б зменшення об’єму і т.д. доти, доки речовина не стяглася б у точку. Таким чином, на ділянці
відповідала б непри-родному положенню, коли стискання речовини призводило б до зменшення тиску, а останнє в свою чергу викли-кало б зменшення об’єму і т.д. доти, доки речовина не стяглася б у точку. Таким чином, на ділянці 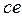 рівняння Ван-дер-Ваальса не описує стан речовини і не є діючим.
рівняння Ван-дер-Ваальса не описує стан речовини і не є діючим.
Точку К, у якій усі три корені сходяться в один, а ділянка прямої сходиться в точку, називають критичною.
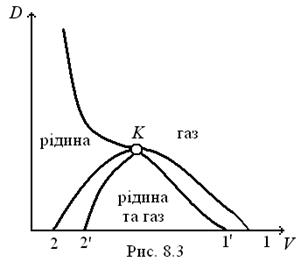
Куполоподібна крива 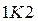 є кривою фазової рівноваги рідини і пари на діаграмі
є кривою фазової рівноваги рідини і пари на діаграмі 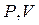 (рис. 8.3). Область між кривими
(рис. 8.3). Область між кривими 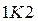 та
та 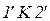 є областю метастабільного стану (праворуч – газу, ліворуч – рідини) за умови рівноважного процесу стискання (або розширення). В області під кривою
є областю метастабільного стану (праворуч – газу, ліворуч – рідини) за умови рівноважного процесу стискання (або розширення). В області під кривою 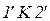 розділена на фази речовина не може існувати навіть в метастабільному стані. Це область двофазного стану.
розділена на фази речовина не може існувати навіть в метастабільному стані. Це область двофазного стану.
|
|
|
Якщо процес стискання відбувається швидко, то область двофазного стану обмежується кривою 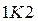 .
.
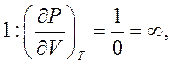 В точці
В точці 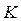 стисливість речовини:
стисливість речовини:
(8.12)
тобто в точці 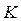 стан речовини є невизначеним. Його називають критичним станом, а точку
стан речовини є невизначеним. Його називають критичним станом, а точку 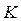 – критичною точкою.
– критичною точкою.
Крива 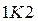 є кривою фазових переходів перетворення однієї фази на іншу. Вона є межею початку або кінця процесу перетворення.
є кривою фазових переходів перетворення однієї фази на іншу. Вона є межею початку або кінця процесу перетворення.
Фазою називають сукупність частин системи, якій притаманні: певна будова речовини, агрегатний стан, хімічний склад і внутрішня енергія.
Енергію, що виділяється або поглинається речовиною при фазових переходах зі зміною агрегатного стану, називають прихованою теплотою (пароутворення, плавлення, кристалізації), а такі фазові переходи називають фазовими переходами першого роду. Всі інші переходи, що не пов’язані зі зміною густини, внутрішньої енергії та виділенням теплоти, але пов’язані зі зміною теплоємності та внутрішньої будови, називають переходами другого роду. Наприклад перехід феромагнетика в парамагнетик або перехід гелію в надтекучий стан можна назвати переходами другого роду.
 2015-09-06
2015-09-06 1594
1594








