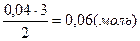Під час хімічних виробництв використовують сировину, яка в основному не являє собою чисту речовину, а містить різноманітні домішки. Ці домішки в процесі виробництва участі не беруть. Тому необхідно провести розрахунки, за якими обчислити масу чистої речовини, яка і буде брати участь в хімічному процесі.
Особливість розв’язування задач даного типу полягає в тому, що слід з’ясувати, що є технічною речовиною, чистою речовиною, а що є домішками. Технічна речовина – це речовина, в якій корисний компонент, забруднений домішками. Визначивши компоненти, користуємось опорними формулами.
 | |||
 |
 Технічна речовина
Технічна речовина
 чиста речовина
чиста речовина
Опорні формули:
m(тex) = m (чист. реч.) + m(дом); m (чист. реч.) = m(тex) – m(дом);
ω%(дом.) = 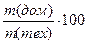 %; ω% (чист. реч.) =
%; ω% (чист. реч.) = 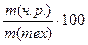 %;
%;
ω%(дом.) + ω% (чист. реч.) = 100%.
Алгоритм розв’язку:
1. Записати повну і скорочену умову задачі.
2. Обчислити масову частку чистої речовини.
3. Обчислити масу чистої речовини.
4. Обчислити кількість чистої речовини.
5. Обчислити за рівнянням реакції кількість продукту реакції.
6. Обчислити масу чи об’єм продукту реакції.
7. Записати відповідь.
Задача 1. Який об’єм водню виділиться при дії хлоридної кислоти на технічний алюміній масою 1,2 г, якщо масова частка домішок, що не реагують з кислотою, 10%?
| Дано: | Розв’язання: | |||||||
| m(Al тех)=1,2 г ω%(дом.)=10% | М(Аl)=27 г/моль; Vm=22,4л/моль
1. Яка маса домішок? m = 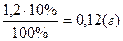 2. Яка маса чистої речовини? m(Al)=1,2 – 0,12=1,08 (г)
3. Яка кількість речовини Al? υ(Al)=1,08:27=0,04 (моль)
4. 6 HCl + 2 Al à 2 AlCl3 + 3 H2
2. Яка маса чистої речовини? m(Al)=1,2 – 0,12=1,08 (г)
3. Яка кількість речовини Al? υ(Al)=1,08:27=0,04 (моль)
4. 6 HCl + 2 Al à 2 AlCl3 + 3 H2
2 моль 3 моль 0,04 моль х Х= 5. Який об’єм водню? V(H2)= 22,4·0,06=1,344 (л) | |||||||
| V(H2)-? | ||||||||
| Відповідь: 1,344 л водню |
 2015-09-06
2015-09-06 695
695