Перший закон термодинаміки є окре-мим випадком закону збереження енергії стосовно термодинамічних систем:
Енергія ізольованої термодинамічної системи залишається незмінною незалеж-но від того, які термодинамічні процеси протікають у цій системі.
Повна енергія системи Н:
H=U+pV=const
dH=dU+d(pV)=0 (1)
U=F+TS
H=F+TS+pV
dH=dF+d(TS)+d(pV)=0 (2)
Як правило, розглядаються системи відкриті (обмінюються енергією та величи-ною).
H=U+pV
dH=dU+d(pV)≤ ≥ 0 (3)
Для таких відкритих систем треба зна-ходити енергетичний баланс між енергією, яка підводиться, і куди ця енергія витра-чається. Якщо прийняти до уваги, що 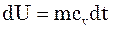 , то сюди можна підставити цю величину.
, то сюди можна підставити цю величину.
V=const
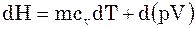
Для випадку, коли теплота підводиться під час незмінного тиску.
P=const
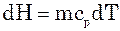
Для цього випадку елементарна тепло-та  Q=m
Q=m 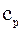 dT;
dT;

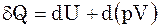
d(pV)=pdV
Vdp=0
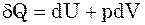 (4)
(4)
Для скінченних величин
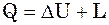 (5)
(5)
dq=du+pdv (6)
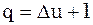 (7) для 1 кг
(7) для 1 кг
Рівняння (4)-(7) вказують енергетич-ний баланс для відкритої системи. Це є ма-тематичний вираз першого закону термо-динаміки:
Якщо до термодинамічної системи під-водиться певна кількість теплоти, то части-на її витрачається на зміну внутрішньої енергії, і друга частина – на виконання ро-боти.
|
|
|
Можна цей баланс виразити через ен-тальпію, коли V=const. Тоді із (3) ми буде-мо мати, що dU=dH-d(pV).
Але так як d(pV)=pdV+Vdp і в даному випадку буде дорівнювати нулю, то:
pdV=0
V=const
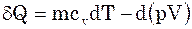 (8)
(8)
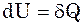
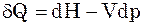 (9),
(9),
де –Vdp називається внутрішньою змі-ною потенціальної енергії тиску.
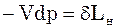
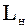 – наявна робота.
– наявна робота.
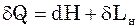 (10)
(10)
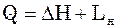 (11)
(11)
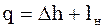 (12)
(12)
Якщо взяти випадок, що Т=const, то із (5) ми отримаємо
Т=const
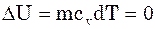
Q=L (13)
Принцип наявності (окреме формулю-вання І закону термодинаміки):
Під час підведення певної кількості те-плоти отримується еквівалентна робота, і навпаки.
Третє формулювання:
Неможливо побудувати вічний двигун І роду: нема і не може бути такого двигуна, який виконує роботу без підведення до ньо-го теплоти.
Розглянемо вираз Клаузіуса 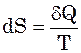 , звідси можна записати, що:
, звідси можна записати, що:
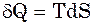 (14)
(14)
Тоді (14) ми можемо підставити в (4), (6), (9).
TdS=dU+pdV
Tds=du+pdv (15)
TdS=dH-Vdp
Рівняння (15) називаються термодина-мічними тотожностями, тому що в ці рі-вняння входять значення всіх шести пара-метрів стану.
 2015-09-06
2015-09-06 344
344








