n А) Скорость реакции зависит от концентрации субстратов и фермента, а химические только от концентрации субстрата.
n Б) От условий взаимодействия: не только от температуры, рН, но и концентрации коферментов и кофакторов, наличия различных эффекторов: активаторов и ингибиторов.
n В) В большинстве своем ферментативные реакции являются реакциями смешанного порядка.
Начальная скорость ферментативной реакции это - скорость ферментативной реакции в тот момент времени, когда факторы, замедляющие скорость ферментативной реакции (нехватка субстрата, специфическое ингибирование продуктами реакции, частичная тепловая денатурация фермента и др.), не успевают проявить свое действие и наблюдается прямая пропорциональная зависимость между продуктами реакции и временем. Она обозначается V0.
Начальная скорость определяется как тангенс угла наклона касательной, проведенной из начала координат к кривой хода ферментативной реакции.
V0=tga
А) Влияние концентрации субстрата на скорость ферментативной реакции. Концентрация субстрата является важнейшим фактором, определяющим скорость ферментативной реакции. Еще в 1902 г. В. Анри при изучении реакции ферментативного гидролиза сахарозы предположил, что фермент фруктофуранозидаза взаимодействует со своим субстратом, затем это соединение распадается, фермент остается в первоначальном виде, а субстрат сахароза оказывается расщепленной на глюкозу и фруктозу.
|
|
|
Это предложение было в дальнейшем развито Л. Михаэлисом и М. Ментен. В 1913 г. они постулировали следующие уравнения ферментативной реакции:
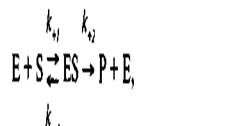
где k+1 — константа скорости реакции образования комплекса ES,
k-1, k+2 — константы скорости реакции распада комплекса ES в двух направлениях.
Тогда— константа диссоциации комплекса ES равна отношению констант скоростей обратной и прямой реакции:
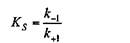
| Исходя из закона действующих масс, можно записать следующее уравнение: |
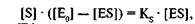
|
где [c0j — концентрация фермента в начале ферментативной реакции, [&] — концентрация субстрата, [ES] — концентрация комплекса «фермент—субстрат», [Е0]—[ES] — концентрация фермента, не связанного в комплексе с субстратом.
В ходе ферментативной реакции в любой момент времени фермент существует в двух формах: свободной и связанной, т. е. в форме комплекса ES.
Скорость ферментативной реакции будет максимальной при такой концентрации субстрата, когда весь фермент перейдет в комплекс ES, т.е. когда все активные центры насыщены субстратом и дальнейшее увеличение концентрации субстрата не приведет к увеличению скорости реакции.
Преобразуя представленное выше уравнение, получим выражение, которое будет иметь следующий вид:
|
|
|
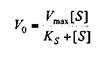
Это уравнение названо уравнением Михаэлиса—Ментен. Оно имеет огромное значение для выражения зависимости действия ферментов от концентрации субстрата. Однако оно содержит и ряд недостатков, в частности, при его выводе было сделано несколько допущений, например, не учитывалась вторая стадия ферментативной реакции — образование Е и Р.
В связи с этим был предложен ряд усовершенствованных уравнений, с учетом влияния образовавшихся продуктов реакции. В настоящее время наиболее широко используют уравнение Холдейна—Бриггса. Оно име-
l 11 1Л 1Л ПЫТТ*
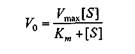
 2015-09-06
2015-09-06 557
557








