Комментарии для работы с рабочими тетрадями.
| 1. MnSO4 + KOH→Обычный обмен с выпадением осадка гидроксида. |
2. Mn(OH)2 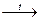 разложение (не ОВР). разложение (не ОВР).
|
| 3. MnF2 + HF→комплексообразование у марганца (2) координационное число 4. |
| 4. MnSO4 + PbO2 + HNO3→ (PbO2)– сильнейший окислитель в кислой среде. Реакция с сульфатом марганца является качественной на ионы Mn2+. Раствор окрашивается в фиолетовый цвет, что указывает на образование перманганат - ионов. |
| 5. MnO2 + KOH→ |
| 6. MnO2 + KOH + O2→ марганец в щелочной среде до манганата, а кислород до воды.. ОВР. |
| 7. MnCl2 + H2O→ гидролиз по катиону. |
| 8. KMnO4 + KI + H2O→ОВР до свободного йода, и диоксида марганца в нейтральной среде. |
| 9. KMnO4 + NaNO2 + H2O→ ОВР до нитрата, и диоксида марганца в нейтральной среде. |
10. KMnO4 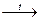 ОВР. ОВР.
|
| 11. MnO + HCl→ Обмен. не ОВР. |
| 12. MnCO3 + HNO3→ Обмен. не ОВР. |
| 13. Mn(CN)2 + KCN→ комплексообразование у марганца (2) координационное число 4. |
| 14. Mn3O4 + HCl→ |
| 15. MnO2 + HCl k.→ОВР Марганец до +2, хлор до молекулярного хлора. |
| 16. K2MnO4 + H2S + H2SO4→ ОВР Марганец до +2, сера до молекулярной серы. |
| 17. K2MnO4 + H2O→ОВР. марганец диспропорционирует на ближайшую меньшую и большую степень окисления. |
| 18. Mn(OH)2 + O2 + H2O→ОВР до пиролюзита. |
| 19. KMnO4 + Na2SO3 + KOH→марганец в щелочной среде до манганата, а сульфит до сульфата. ОВР. |
20. Mn(NO3)2 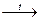 ОВР ОВР
|
Индивидуальные задания:
1 вариант:
| Напишите формулы возможных оксидов марганца и соответствующих им гидроксидов. С помощью химических реакций охарактеризуйте их кислотно-основное свойства. | марганец образует ряд оксидов, в которых проявляет весь диапазон степеней окисления. С возрастанием степени окисления ослабляется основной характер оксида и соответственно усиливаются их кислотные свойства. Гидроксиды основных оксидов являются основаниями, кислотных – кислотами. Подтверждением основных свойств оксида является взаимодействие его с кислотами, кислотных- с основаниями. Оксид и гидроксид Mn(IV) являются амфотерными, т.е взаимодействуютис кислотами, и с основаниями. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
MnO2® K2MnO4® KMnO4® MnCl2®Mn(OH)2
Почему диоксид марганца может проявлять и окислительные, и восстановительные свойства? Исходя из электронных уравнений, составьте уравнения реакций:
MnO2 + KJ + H2SO4 ® …, MnO2 + КNО3 + КОН ®…
2 вариант:
Составьте уравнения реакций, которые надо провести для осуществления превращений:
KMnO4® K2MnO4® MnO2®MnSO4 ®HMnO4
Как меняется степень окисления КMnO4 в кислой, нейтральной и щелочной средах? Составьте уравнения реакций между КМnO4 и KNO2 в нейтральной среде. Коэффициенты расставьте на основании электронных уравнений.
| Напишите молекулярные уравнения реакций, соответствующих переходу ионов: MnO4- ↔ Mn2+; MnO4- ↔ MnО2; MnO4- ↔ MnO42-; Mn2+ ↔ MnO4-; | Перманганат – ион MnO4- содержит марганец в высшей степени окисления (+7), следовательно, в окислительное – восстановительных реакциях перманганат- ион будет всегда выступать в роли окислителя. Продукты его восстановления зависят от величины рН среды. Образование ионов Mn2+ и связанное с этим обесцвечивание раствора будет происходить в кислой среде. Бурый осадок MnО2 образуется в нейтральном растворе. Переход MnO4- ↔ MnО4 2-, вызывающий окрашивание раствора в зеленый цвет – в щелочной среде. В качестве восстановителей в данных могут быть использованы сероводород, сульфиды, сульфидты, соединения Fe(II) и т.п. степень окисления +2 является для марганца низшей, поэтому соединения, содержащие Mn2+, в окислительно- восстановительных процессах могут быть только восстановителями. Для их перевода в перманганат – ион необходимы очень сильные окислители (NaBiO3). |
3 вариант:
Составьте уравнения реакций, которые надо провести для осуществления превращений:
MnO2® K2MnO4® KMnO4® MnO2
MnSO4 + PbO2 + HNO3→ (PbO2)– сильнейший окислитель в кислой среде. Реакция с сульфатом марганца является качественной на ионы Mn2+. Раствор окрашивается в фиолетовый цвет, что указывает на образование перманганат - ионов.
MnO2 + KOH + O2→ марганец в щелочной среде до манганата, а кислород до воды.. ОВР.
KMnO4 + KI + H2O→ОВР до свободного йода, и диоксида марганца в нейтральной среде.
KMnO4 + Na2SO3 + KOH→марганец в щелочной среде до манганата, а сульфит до сульфата. ОВР.
KMnO4 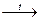 ОВР.
ОВР.
MnO2 + HCl k.→ОВР Марганец до +2, хлор до молекулярного хлора.
K2MnO4 + H2S + H2SO4→ ОВР Марганец до +2, сера до молекулярной серы.
K2MnO4 + H2O→ОВР. марганец диспропорционирует на ближайшую меньшую и большую степень окисления.
. Mn(OH)2 + O2 + H2O→ОВР до пиролюзита.
KMnO4 + NaNO2 + H2O→ ОВР до нитрата, и диоксида марганца в нейтральной среде.
 2015-10-16
2015-10-16 1017
1017








