Комментарии для работы с рабочими тетрадями.
| 1. FeCl3 + Cu→ОВР Железо окислитель, медь восстановитель. Эту реакцию используют в радиотехнике. |
| 2. FeCl3 + H2O→гидролиз по катиону. |
| 3. Fe3O4 + H2SO4→обмен сообразованием 2-х солей железа. |
| 4. Ni(OH)2 + Br2 + NaOH→ОВР бром окислитель на (-1), никель восстановитель на (+3). |
5. Fe2O3 + NaOH  обмен образуется мета феррат (3). обмен образуется мета феррат (3).
|
| 6. Fe(OH)3 + NaOH→ соединение не ОВР. у железа (+3) координационное число 6. |
7. Co(OH)2 
|
| 8. FeCI3 + KCNS→Обмен, роданит железа (3) кровавого цвета. Качественная реакция на железо (+3). |
| 9. FeCI2 + K3[Fe(CN)6] →Обмен. Качественная реакция на железо (+2). Турнбуленова синь или берлинская лазурь. |
| 10. FeCI3 + K4[Fe(CN)6] → Обмен. Качественная реакция на железо (+3). Турнбуленова синь или берлинская лазурь. |
| 11. Fe(CN)2 + KCN → Составьте уравнения реакций, которые надо провести для осуществления превращений: комплексообразование. У железа (+2) координационное число 6. Желтая кровяная соль образуется. |
| 12. K4[Fe(CN)6] + CI2 → хлор окислитель, железо (2) восстановитель. Из желтой кровяной соли образуется красная кровяная соль. |
| 13. Co(OH)2 + O2 +H2O → |
14. Co(NO3)2  ОВР ОВР
|
15. FeC2O4 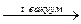
|
16. [Ni(CO)4] 
|
| 17. NaFeO2 + H2O → гидролиз по аниону. |
| 18. Ni(OH)3 + HCI→ обмен. |
| 19. Fe + HNO3p→ ОВР. |
| 20. CoSO4 + H2O→ гидролиз по катиону. |
Индивидуальные задания:
|
|
|
1 вариант:
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Fe (OH)3 ® Fe2O3 ® FeCl3 ® FeCl2 ® K4[Fe(CN)6]
Fe ® FeCl2 ® Fe ® Fe(NO3)3 ® Fe2O3 ® FeO ® FeSO4 ® Fe(OH)2 ® FeO ® Fe ® FeS.
Какую степень окисления проявляет железо в соединениях? Как можно обнаружить ионы Fе2+ и Fe3+ в растворе? Составьте молекулярные и ионные уравнения соответствующих реакций.
| Составьте уравнения реакций, подберите коэффициенты электронно – ионным методом: FeCI3 + Br2 + NaOH→, KJ + FeCI3 →.Сделайте вывод об окислительно – восстановительном двойственности иона Fe3+. | Степень окисления +3 для железа является промежуточной, поэтому соединения Fe(III) при взаимодействии с сильными восстановителями (Н2S, KJ) восстанавливаются до Fe(II). А при взаимодействии с таким сильным окислителем как бромная вода в щелочной среде они окисляются с образованием феррата натрия (Na2FeO4). |
2 вариант:
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Fe® FeCl3® Fe(OH)Cl2 ® FeCl3® K3[Fe(CN)6]
Fe ® FeSO4 ® Fe(OH)2 ® FeO ® Fe ® Fe3O4 ® Fe2O3® Fe(NO3)3 ® Вa(NO3)2 ® KNO3 ® KNO2.
Составьте молекулярные и ионные уравнения реакций, которые надо провести для осуществления превращений:
Fe ® FeCl2 ® Fe(CN)2 ® К4[Fe(CN)6].
| Определите степень окисления, электронную конфигурацию и тип гибридизации атомных орбиталей комплексообразователей, пространственную структуру комплексных ионов: [Au(CN)6]-, [Zn(OH)4]2-, [Cо(NH3)4]3+. Объясните их магнитные свойства. | При выполнении данного задания в качестве образца необходимо использовать пример 3 темы «Комплексные соединения». |
3 вариант:
|
|
|
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Fe® FeSO4 ® Fe(OH)2® Fe(OH)3 ® FeCl3® K3[Fe(CN)6]® K4[Fe(CN)6]
Fe ® FeCl3 ® Fe(OH)3 ® Fe2O3 ® FeO ® FeSO4 ® Fe ® FeS ® Fe2O3 ® Al2O3 ® Al.
| Напишите электронные формулы ионов: Fe2+, Cо2+, Ni2+. Сравните их восстановительную активность. Приведите примеры соответствующих реакций. Подберите коэффициенты электронно – ионным методом. | При ответе на данный вопрос сначала необходимо написать электронные формулы для атомов Fe, Cо, Ni, затем для их ионов, учитывая, что Э - 3ē→Э3+. Окислительная активность ионов Fe3+- Cо3+- Ni3+ увеличивается. Если для перехода Fe3+→ Fe2+ необходимы сильные восстановители, то Cо2+, Ni2+ можно получить даже при подкислении растворов соответствующих гидроксидов Cо(OH)3, Ni(OH)3. |
Составьте уравнения реакций, которые надо провести для осуществления превращений: Ni ® Ni(NO3)2 ® Ni(ОH)2 ® Ni(ОН)3 ® NiCl2. Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
4 вариант:
| Напишите координационные формулы комплексных соединений никеля: а) тетрохлороникколат (II) калия; б) тетроцианоникколат (II) калия. Объясните магнитный свойства каждого соединения, тип гибридизации комплексообразователя и пространственную конфигурацию комплексного иона. | При выполнении данного задания в качестве образца необходимо использовать пример 3 темы «Комплексные соединения». |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Fe® Fe2(SO4)3® Fe(OH)SO4 ® Fe(OH)3 ® FeCl3® K3[Fe(CN)6]
Co®CoCl2 ® Co(OH)2®Co(OH)3
| Напишите электронные формулы ионов: Fe2+, Cо2+, Ni2+. Сравните их восстановительную активность. Приведите примеры соответствующих реакций. Подберите коэффициенты электронно – ионным методом. | При выполнении данного задания прежде всего следует написать электронные формулы атомов Fe, Cо, Ni.Затем – ионов, учитывая, что атомы этих элементов отдают электроны с последнего 4s – подуровня: Э - 2ē→Э2+. Сравнить восстановительную активность этих ионов – значит указать, с помощью каких окислителей можно применение таких окислителей, как кислород, пероксид водорода, перманганат или дихромат калия. Для окисления Ni2+ необходимо воздействие хлорной или бромной воды в щелочной среде. |
5 вариант:
| Напишите молекулярные и ионные уравнения реакции гидролиза солей: FeCI2, NiSO4. Укажите реакцию средыкаждого раствора. | Указанные соли образованы катионами слабых оснований и анионами сильных кислот. Для процессов диссоциации данных соединений необходимо написать соответствующие уравнения. Гидролиз во всех трех случаях будет происходить по катиону. Результатом первой степени гидролиза будет образование основных солей и соответствующих кислот. Поскольку по следующим ступеням гидролиз происходит в незначительной степени, достаточно будет привести уравнения только для первой ступени. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Fe® FeCl3® Fe(OH)Cl2 ® FeCl3® K3[Fe(CN)6]
Co® CoSO4® Co(OH)2®[ Co(NH3)4](OH)2
| Напишите молекулярные и ионные уравнения реакций, протекающих в растворах электролитов: FeSO4 + К3[Fe(CN)6] →, FeCI3 + KNCS →, FeCI3 + К4[Fe(CN)6]→. Назовите полученные вещества и укажите, с какой целью эти реакции используются для аналитической химии. | Поскольку предложенные реакции являются качественными на катионы Fe3+, Fe2+, необходимо указать изменение цвета и агрегатного состояния реагирующих веществ. При составлении уравнений реакций, в которых принимают участие комплексные соединения, следует учитывать, что внутренняя сфера комплекса не изменяется, обменные процессы происходят во внешней среде. |
Таблица распределения номеров индивидуальных заданийдля соответствующих каждому варианту.
|
|
|
| Тема № | ||||||||||||
| 1в. | ||||||||||||
| 2в. | ||||||||||||
| 3в. | ||||||||||||
| 4в. | ||||||||||||
| 5в. | ||||||||||||
| 6в. | ||||||||||||
| 7в. | ||||||||||||
| 8в. | ||||||||||||
| 9в. | ||||||||||||
| 10в. | ||||||||||||
| 11в. | ||||||||||||
| 12в. | ||||||||||||
| 13в. | ||||||||||||
| 14в. | ||||||||||||
| 15в. | ||||||||||||
| 16в. | ||||||||||||
| 17в. |
Учебное издание
Апанович Зинаида Васильевна
Лукашенко Юрий Альфредович
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
И ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
 2015-10-16
2015-10-16 824
824








