Определение качества воды
Качество воды, предназначенной для технологических целей, имеет большое значение. Качество воды определяют по комплексу органолептических, физико-химических и бактериологических показателей в соответствии с требованиями ГОСТ 2874 «Вода питьевая».
Правила отбора проб воды.
1. Пробу воды из водопровода отбирают в месте ее наибольшего расхода и в момент наибольшего расхода воды. В течение 5 мин воду спускают из крана, бутыль 3 раза ополаскивают водой, после чего набирают 2-3 л и закрывают бутыль пробкой.
2. Проба воды из водоема отбирается с глубины 75-100 см в бутыль с грузом.
6.1. Определение температуры.
Проведение испытания:
Температура замеряется через 5-10 мин после спуска воды из крана с точностью до 0,10С.
6.2. Определение запаха и вкуса.
Запах определяется органолептически.
Проведение испытания:
Определение запаха воды проводят при температуре 15-200С. Воду наливают в широкогорлую колбу емкостью 150-200 мл до 2/3 объема, накрывают часовым стеклом и взбалтывают вращательными движениями, после чего снимают стекло и быстро испытывают запах.
|
|
|
Запах определяется по балльной системе:
| 0 – отсутствует | 3 – заметный |
| 1 – очень слабый | 4 – отчетливый |
| 2 – слабый | 5 – очень сильный |
Запах при температуре 200С не должен быть более 2 баллов.
При проведении испытания воздух помещения должен быть чистым (без запаха), также необходимо обеспечить отсутствие запаха от рук и одежды наблюдателя.
Запах в воде может быть естественного происхождения (от грунта, растительности, живых организмов), например, болотный, травянистый, илистый, и искусственного – (от промышленных сточных вод и обработки воды химическими реагентами), например, фенольный, хлорный, нефтепродуктов.
Вкус также определяется органолептически.
Проведение испытания:
Для определения вкуса воду набирают в рот малыми порциями, не проглатывая, и задерживают на 3-5 с. Различают соленый, кислый, горький и сладкий вкус. Прочие ощущения называются привкусами. Интенсивность вкуса и привкуса определяют по вышеизложенной балльной системе (при температуре 200С вкус не должен быть более 2 баллов). Вкус определяют у сырой воды, за исключением случаев, когда вода является сомнительной в санитарном отношении. В таком случае воду кипятят, охлаждают до комнатной температуры и определяют вкус. При записи результатов отмечают «вкус кипяченой воды».
6.3. Определение прозрачности.
Проведение испытания:
Прозрачность определяется визуально путем сравнения с дистиллированной водой и количественно в цилиндре Генера. Цилиндр Генера имеет плоское дно, градуирован по высоте и у дна снабжен краном для спуска воды. Нефильтрованную воду хорошо взбалтывают и наливают в цилиндр, который ставят на страницу со стандартным шрифтом. Затем через кран спускают воду до тех пор, пока через оставшийся в цилиндре столб воды ясно не обозначится шрифт. Столб воды в цилиндре, отсчитанный в сантиметрах, выражает степень прозрачности. Во избежание оседания мути на дно цилиндра определение проводят как можно быстрее. Прозрачность питьевой воды по шрифту должна быть не менее 30 см.
|
|
|
6.4. Определение реакции воды.
Изменение окраски воды при добавлении к ней индикаторов характеризует реакцию воды, т.е присутствие в ней ионов 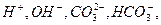 обуславливающих ту или иную величину рН. Реакцию воды обычно определяют по метиловому оранжевому, который имеет красную окраску в кислой среде и оранжево-желтую – в щелочной и изменяет окраску при рН 3,6 (3,1-4,4), и по фенолфталеину, который бесцветен в кислой среде, имеет малиновую окраску – в щелочной и изменяет окраску при рН 8,3 (8,2-10).
обуславливающих ту или иную величину рН. Реакцию воды обычно определяют по метиловому оранжевому, который имеет красную окраску в кислой среде и оранжево-желтую – в щелочной и изменяет окраску при рН 3,6 (3,1-4,4), и по фенолфталеину, который бесцветен в кислой среде, имеет малиновую окраску – в щелочной и изменяет окраску при рН 8,3 (8,2-10).
Проведение испытания:
В пробирку с водой добавляют 3-5 капель индикатора и, наблюдая за окраской, отмечают один из следующих вариантов:
| Вариант | Вода содержит ионы |
| 1. Вода желтая с метиловым оранжевым и розовая с фенолфталеином | 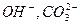
|
| 2. Вода желтая с метиловым оранжевым и бесцветная с фенолфталеином | 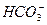
|
| 3. Вода оранжевая с метиловым оранжевым и бесцветная с фенолфталеином | 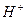
|
6.5. Определение рН.
Величину рН измеряют на рН-метре. рН питьевой воды по ГОСТ 2874 должен находиться в пределах 6,5-8,5.
6.6. Определение содержания взвешенных веществ (мутности).
Проведение испытания:
В бюксу с притертой крышкой укладывают плотный складчатый фильтр (Æ 9-11 см) и сушат до постоянной массы при температуре 1050С. Тщательно взболтанную воду отливают в несколько приемов в мерный стакан до метки «100 мл». Воду фильтруют через фильтр, пользуясь воронкой Бюхнера, колбой Бунзена и водоструйным насосом. Фильтр складывают в ту же бюксу и высушивают до постоянной массы при температуре 1050С.
Мутность воды (М) в мг/л определяют по формуле:
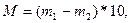
где m1 – масса бюксы и фильтра со взвешенными веществами, мг;
m2 – масса бюксы и пустого фильтра, мг;
Вычисление производят с точностью до 0,1 мг/л.
Мутность питьевой воды по ГОСТ 2874 не должна превышать 1,5 мг/л.
Профильтрованную воду используют для определения содержания сухого остатка (п. 6.7.)
6.7. Определение содержания сухого остатка.
Проведение испытания:
100 мл профильтрованной воды выпаривают в предварительно высушенной до постоянной массы и взвешенной фарфоровой чашке. Затем чашку с сухим остатком высушивают до постоянной массы при температуре 1050С и взвешивают.
Содержание сухого остатка (Х) в мг/л определяют по формуле:
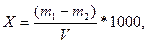
где m1 – масса чашки с сухим остатком, мг;
m2 – масса пустой чашки, мг;
V – объем воды, взятой для анализа, мл
Вычисление производят с точностью до 0,1 мг/л.
Содержание сухого остатка в питьевой воде по ГОСТ 2874 не должно превышать 1000 мг/л.
6.8. Определение окисляемости марганцевокислым калием.
Окисляемость марганцевокислым калием является условным показателем, характеризующим содержание в воде восстановителей (окисляющихся веществ).
Окисляемость определяют на холоде и при нагревании. Первая характеризует содержание в воде легкоокисляемых веществ (закисного железа, сульфидов, сульфитов, нитритов и т.д.), вторая – более трудноокисляемых органических веществ.
Окисляемость выражают количеством миллиграммов марганцевокислого калия или количеством миллиграммов кислорода, идущего на окисление веществ, содержащихся в 1 л исследуемой воды.
Сущность метода состоит в том, что марганцевокислый калий, будучи сильным окислителем, реагирует в присутствии серной кислоты с содержащимися в воде восстановителями:
|
|
|
2КMnO4 + 3H2SO4 = 2MnSO4 + K2SO4+ 3H2O + 5O
Избыток марганцевокислого калия связывается с вводимой в раствор щавелевой кислотой:
5С2Н2О4 + 2КMnO4 + 3H2SO4 = 2MnSO4 + К2SO4 + 8H2O + 10СO2
Не вступившая в реакцию избыточная щавелевая кислота оттитровывается обратно раствором марганцевокислого калия.
Проведение испытания:
В коническую колбу емкостью 250 мл наливают пипеткой 100 мл исследуемой воды, прибавляют 5 мл серной кислоты (1:3) и из бюретки 10 мл 0,01 н раствора марганцевокислого калия. Полученную смесь выдерживают 10 мин при комнатной температуре (если окисляемость определяется на холоде) или нагревают до кипения на водяной бане и кипятят 10 минут (если окисляемость определяется при нагревании). Затем в колбу приливают 10 мл 0,01 н раствора щавелевой кислоты и обесцветившийся раствор титруют 0,01 н раствором марганцевокислого калия до появления стойкого бледно-розового окрашивания. Во втором случае титруют горячий раствор.
Отметив количество израсходованного на титрование марганцевокислого калия (V1), добавляют еще 10 мл 0,01 н раствора щавелевой кислоты, чтобы установить соотношение между растворами, и обесцветившийся раствор титруют 0,01 н раствором марганцевокислого калия до появления стойкого бледно-розового окрашивания.
Окисляемость (О) в мг КMnO4/л воды определяют по формуле:
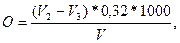
где V2 – общее количество 0,01 н раствора марганцевокислого калия, прибавленного к воде в начале опыта и израсходованного на титрование избытка щавелевой кислоты (10+ V1), мл;
V3 – количество 0,01 н раствора марганцевокислого калия, израсходованного на титрование 10 мл 0,01 н раствора щавелевой кислоты, мл;
V – объем воды, взятой для анализа, мл;
0,32 – количество КMnO4, соответствующее 1 мл 0,01 н раствора, мг.
Для условного выражения окисляемости в мг О2/л результат делят на 4.
Вычисление проводят с точностью до 0,1 мг КMnO4/л.
6.9. Определение жесткости воды.
Жесткость воды обуславливается содержанием в ней солей щелочноземельных металлов (кальция и магния), и выражается в микромолях на 1 л воды или в условных единицах – градусах. Один градус жесткости соответствует содержанию 0,01 г оксида кальция в 1 л воды. Содержащиеся в воде соли магния пересчитывают на оксид кальция.
|
|
|
Различают общую, постоянную и устранимую жесткость.
Общая жесткость – это общее количество солей кальция и магния в исследуемой (не кипяченой) воде.
Постоянная жесткость – это количество тех же солей, оставшихся после кипячения воды в течение 1 часа.
Устранимая жесткость – это содержание солей, осаждающихся при кипячении воды. Согласно ГОСТ 2874 общая жесткость не должна превышать 7 мкмоль/л.
Общую жесткость определяют методом трилонометрического титрования. Трилон Б, являющийся двунатриевой солью этилендиаминтетрауксусной кислоты (NаЭДТА), образует прочные комплексы с ионами двухвалентных металлов, в частности с ионами кальция и магния.
Проведение испытания:
В коническую колбу емкостью 250 мл пипеткой отмеряют такое количество воды, суммарное содержание ионов кальция и магния в котором не превышает 0,5 мкмоль/л. Для упрощения рекомендуется пользоваться данными таблицы 1.
Таблица 1
| Предполагаемая жесткость воды | Количество воды для анализа, мл | |
| мкмоль/л | град | |
| 0,5 – 5 | 1,4 – 14 | |
| 5 – 10 | 14 – 30 | |
| 10 – 20 | 30 – 56 | |
| 20 – 50 | 56 – 140 |
К отобранной пробе приливают дистиллированную воду, доводя количество содержимого колбы до 100 мл (если это необходимо), добавляют 5 мл аммиачного буферного раствора и 7-8 капель индикатора хромтемносинего. Содержимое колбы, интенсивно перемешивая, титруют 0,1 н раствором трилона Б до перехода окраски от винно-красной до синей с зеленоватым оттенком.
Аммиачно-буферный раствор готовят следующим образом: в мерной колбе на 1 л смешивают 100 мл 20%-го раствора NH4Cl и 100 мл 20%-го раствора NH3, доводят содержимое дистиллированной водой до метки. рН смеси должно быть равно 10.
Общую жесткость воды (ОЖ) в мкмоль/л воды определяют по формуле:
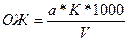
Общую жесткость воды (ОЖ) в градусах определяют по формуле:
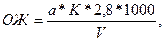
где а – количество 0,1 н раствора трилона Б, пошедшего на титрование, мл;
К – поправочный коэффициент для 0,1 н раствора трилона Б;
V – объем воды, взятой для анализа;
2,8 – количество миллиграммов оксида кальция, соответствующее 1 мл 0,1 н раствора трилона Б;
Вычисление производят с точностью до 0,01.
6.10. Определение содержания хлоридов.
Метод основан на осаждении хлор-иона в нейтральной или слабощелочной среде азотнокислым серебром.
Проведение испытания:
В пробирку наливают 5 мл исследуемой воды и добавляют 3 капли 10%-го раствора азотнокислого серебра. Примерное содержание хлор-иона определяют визуально в соответствии с таблицей 2.
Таблица 2
| Наблюдаемый эффект | Содержание хлор-иона, мг/л |
| Муть | 1 – 50 |
| Хлопья | 50-100 |
| Осадок | более 100 |
6.11. Определение содержания свободного (активного) хлора в хлорированной воде.
Хлорирование применяется с целью дезинфекции воды, а также для придания ей асептических свойств. Согласно ГОСТ 2874 содержание активного хлора в питьевой воде допускается в пределах от 0,3 до 0,5 мг/л.
Обнаружение активного хлора в воде основано на способности свободного хлора вытеснять йод из раствора йодистого калия в эквивалентном количестве. Выделившийся йод дает синее окрашивание с раствором крахмала. Количественное определение проводят путем титрования раствором серноватистокислого натрия.
2КJ + 2 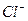 = 2J + 2KCl
= 2J + 2KCl
2J + 2Na2S2O3 = 2NaJ + Na2S4O6
Проведение испытания:
В коническую колбу на 250 мл наливают 5 мл 10%-го раствора йодистого калия добавляют 100 мл исследуемой воды, содержимое подкисляют путем добавления 2 мл серной кислоты (1:3). Содержимое колбы титруют 0,01 н раствором серноватистокислого натрия до получения слабой желтоватой окраски. Затем прибавляют 2-3 мл 1%-го раствора крахмала и продолжают титровать до полного исчезновения синего окрашивания.
Содержание свободного хлора (Х) в мг/л воды определяют по формуле:
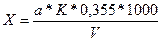 ,
,
где а – количество 0,01 н раствора серноватистокислого натрия, пошедшее на титрование, мл;
К – поправочный коэффициент для 0,01 н раствора серноватистокислого натрия;
0,355 – количество хлора, эквивалентное 1 мл 0,01 н раствора серноватистокислого натрия, мг;
V – объем воды, взятой для анализа, мл.
Вычисление проводят с точностью до 0,1 мг/л.
 2015-10-16
2015-10-16 369
369








