Бұл ферментке абсолюттік субстраттық әсерлесу ерекшелігі тән - гистидинді гистаминге айналдырады:
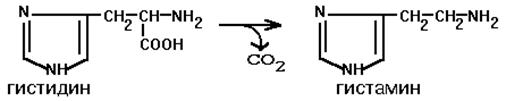
Гистамин медиатор болып табылады және жүйке жасушалары мен мес (тучный) жасушаларында кездеседі. Күшті тамыр кеңейткіш әсерге қабілетті. Гистамин секреторлық гранулаларда сақталады және қанға ұлпаның зақымдалған кезінде (соққы, күю және т.б.) секреттеледі. Ол көп мөлшерде қабыну ошақтарында бөлінеді. Гистамин аллергиялық реакциялардың дамуында маңызды роьді атқарады. Гистаминге арналған рецепторлардың екі типі белгілі: H1 және H2.
Гистаминнің әсері:
- капиллярларды кеңейту және тамыр өткізгіштігін жоғарлату;
- артериалдық қысымды төмендету;
- жазық бұлшықеттердің тонусының жоғарлатуы (спазм) - сонымен бірге кеңірдектің жазық бұлшықеттерінің де;
- асқазан сөлінің секрециясын күшейту;
Бұл әсерлердің кейбіреулері гистаминнің аллергиялық байқалулардың қалыптасуына қатысуына мүмкіндік береді. Антигистаминдік препараттар гистаминнің түзілуін болдырмау мақсатында қолданылады және ісікке қарсы және антиаллергиялық әсерге қабілетті болады. Әсерлерінің механизмі бойынша олардың кейбіреулері гистидиндекарбоксилазаның ингибиторлары, ал басқалары гистаминмен жасуша рецепторына әсерлесу үшін бәсекелеседі.
Н1 -рецепторлардың блокаторлары негізінен аллергияға қарсы зат ретінде қолданылады - димедрол, супрастин және т.б..
4. Сериндекарбоксилаза. Сериннен ацетилхолин түзілуінің бірінші реакциясын катализдейді. Ацетилхолин – вегетативті жүйке жүйесінің қоздырушы медиаторы.
5. Ароматтық аминоқышқылдардың декарбоксилазасы: Әртүрлі субстраттық әсерлесу ерекшелігіне қабілетті. Бірнеше әртүрлі аминоқышқылдармен әсерлеседі:
а) триптофанды - триптаминге
б) 5-окситриптофанды - триптаминге (серотонин)
в) 3,4-диоксифенилаланинді - дофаминге
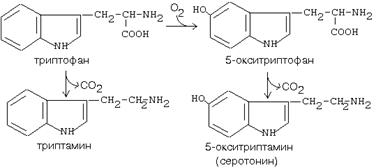
Серотонин жүйке ұлпасында өндіріледі. Бас ауруларының кейбір түрлері сақиан (мигрень) серотониннің артық мөлшерде өндірілуіне байланысты. Серотонин тамырдарды тарылтады, қанның ұюын реттеуге қатысады. Антиаллергиялық әсерге қабілетті. Триптамин осыған ұқсас әсерде болады.
Фенилаланин аминоқышқылы тотығу нәтижесінде сақинасына екі ОН – тобын қосып диоксифенилаланинге (ДОФА) айналады. Одан ароматтық аминоқышқылдар декарбоксилазасы әсерінен дофамин түзіледі. Дофамин катехоламиндер –норадреналин мен адреналиннің алғызаты болып табылады.
Алғазат ретіндегі қызметтен басқа дофамин өзіне тән спецификалық қызметті де атқарады.
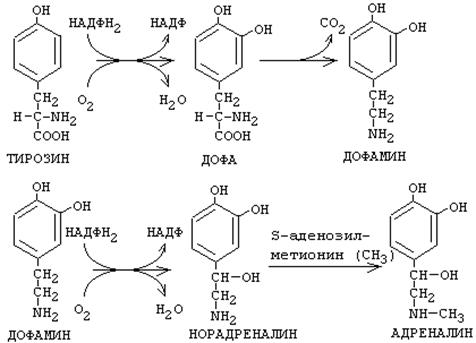
Биогендік аминдердің инактивтелуі
Ағзада биогендік аминдерді ыдыратуға мүмкіндік беретін реакциядың келесі механизмдері болады.
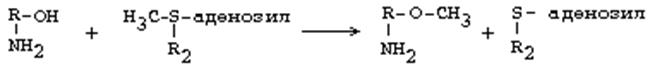
1. Құрамында окситоптары болатын немесе окситоптарды молекуласына гидроксилденуден кейін қосатын аминдерді окситоптары бойынша метилдендіру реакциясы. Метилдік радикалдың шығу көзі: S-аденозилметионин. Реакцияны О-метилтрансфераза ферменттері катализдейді. Олар метилдік топты оттекке ауыстырып қосады. Себебі, метиониннің күкіртіне АДФ-тің аденилдік қалдығын қосқан кезде оның метилдік тобы қозғалғыш болады да әртүрлі заттарға жеңіл ауыстырылады. Сондықтан окситоптағы оттекке де жеңіл ауысады.
2. Аминді дезаминдеу мақсатында аминотоп бойынша тотықтыру реакциясы.
Бұл биогендік аминдерді инактивтеудің негізгі жолы – оларды аминотопты оксидаза (моноаминооксидаза, МАО) әсерінен тотықтырып бөлу. Нәтижесінде аминнің биологиялық активтілігі жоғалады.

Биогендік аминдердің оксидазалары: моноаминооксидаза (МАО), диаминооксидаза (ДАО), полиаминооксидаза. Оксидазалар екі протон мен екі электронды бөліп алып бірден оттекке береді. Сутек асқынтотығы түзіледі, ал амин иминге айналады. Имин ары қарай фермент қатысуынсыз гидролизденіп альдегидке айналады. Оксидаза ферменттерінің простетикалық тобы ретінде ФАД немесе ФМН болады, немесе олар флавопротеин болып табылады.
Екінші реакция (гидролиз) қайтымсыз. Ары қарай, түзілген альдегид карбон қышқылына дейін оңай тотығады. Карбон қышқылы СО2 мен H2O –ға дейін тотығады. Жасушада МАО ДАО-мен салыстырғанда көп болады.
МАО активтілігін басу биогендік аминдердің ыдырауының баяулауына әкеледі. Мұндай дәрілік препараттар биогендік аминдердің «өмір сүру» кезеңін ұзартады, бұл олардың жетіспеушілігі кезінде өте маңызды болып табылады. Бұл заттар антидепрессанттар қызметін атқарады және бір жағынан шизофренияны емдеу кезінде қолданылады.
Аминоқышқылдар цитоплазмада декарбоксилденеді, ал аминдердің тотығуы митохондрияның сыртқы мембранасында өтеді. Аминоқышқылдардың декарбоксилдену реакциясы және биогендік аминдердің ыдырауы бір мезгілде жүрмейтіндіктен биогендік аминдер біршама уақытқа «өмір сүре» және өзінің биологиялық қызметін орындай алады.
2.Трансметилдендіру. Цистеин, серин, глициндердің алмасуының ерекшеліктері. Тетрагидрофолий қышқылы және бір көміртекті топтардың синтезі.
Алмасудың бұл жолы аминоқышқылдардағы радикалдардың құрлысының әртүрлілігімен ерекшелінеді, сондықтан олар әртүрлі және көптүрлі. Бұл спецификалық реакцияларға түскенде аминоқышқылдар көптеген келесі маңызды процестерге қатысады:
а) гормондар мен нейромедиаторлар синтезіне,
б) күрделі белоктардың простетикалық топтарының синтезіне - хромопротеиндердің және нуклеопротеиндердің,
в) күрделі дипидтердің синтезіне,
г) жасуша үшін энергия көзі болатын, құрамында макроэргиялық байланысы бар заттардың синтезіне,
д) улы заттарды залалсыздандыруға.
Аминоқышқылдар бұл процестерге түскенде, өзінің өзінің бүкіл молекуласымен бірге де немесе кейбір фрагменттерімен де (топтарымен) қатыса алады. Оларға аминотоптар (-NH2) және біркөміртекті фрагменттер: -СН3, -CH2-, -С=О, -СН=, -СН2ОН жатқызылады.
Біркөміртекті фрагменттер аминоқышқылдар - глицин, серин, аланин, треониндерден ферменттер әсерінен түзіледі, олардың коферменттері тетрагидрофоллий қышқылы (ТГФҚ, ол Вс витаминінің туындысы). Ол фоль қышқылынан НАДФН2 көмегімен тотықсыздану нәтижесінде түзіледі. ТГФҚ-мен байланысқан біркөміртекті фрагментті активті біркөміртекті фрагмент немесе активті С1 деп атайды.
Глицин мен сериннің алмасуы.
Бұл ауыстырылатын аминоқышқылдар, олар бір біріне айнала алады. Глициннің негізгі ыдырау жолында СО2, Н2О жәнеметилен-ТГФК (активті С1) түзіледі:
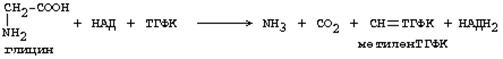
Метилен-ТГФК-дан активті С1-дің басқа да формалары түзіледі: формил-ТГФК, метил-ТГФК, метен-ТГФК, оксиметил-ТГФК. Бұл метилен-ТГФК-ның тотығу және тотықсыздану реакцияларына қатысуының нәтижесі болып табылады.
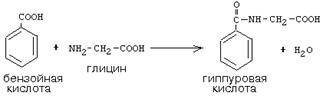
Активті С1, глициннен түзілген, пуриндік азоттық негіздердің синтезіне қатысады. Мұнан басқа, глициннің бүкіл молекуласы гемоглобиннің және басқа да гемопротеиндердің гемінің, пуриндік азоттық негіздердің, жұп өт қышқылдарының (гликохоль қышқылы), креатиннің, трипептид глютатионның синтездеріне қатысады. Бауырда глицин бензой қышқылының заласыздануына қатысып оны гиппур қышқылына айналдырады:
Сериннің негізгі ыдырау жолында метилен-ТГФК және глицин түзіледі:
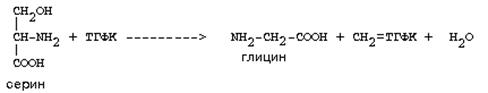
Сериннің бүкіл молекуласы күрделі липидтер – фосфолипидтердің синтезіне қатысады. Ол синтезге қатысып фосфатидилсеринді түзеді, ол декарбоксилденіп фосфатидилэтаноламинге айналады, соңғысы метилденуден кейін фосфатидилхолинге айналады. Метилдену реакциясына метиониннің активті формасы - S-аденозилметионин қатысады.
Серин фермент-белоктар құрамында ферменттің каталиттік орталығының қалыптасуына қатысады, мысалы, сериндік протеазалардағы: типсинде, химотрипсинде және т.б. Серин белоктардың гидраттқ қабықтарының қалыптасуына да қатысады, себебі ол полярлы аминоқышқыл.
Күкіртқұрамды аминоқышқылдардың: метионин мен цистеиннің алмасуы
Метионин – бұл ауыстырылмайтын, ал цистеин ауыстырылатын аминоқышқылдар.

Метионин алмасуының негізгі ерекшелігі бұл одан да активті С1 –ді СН3- тобы түрінде түзуі. Бұл топ әртүрлі синтездерге қатысады. Ерекшелігі сол бұл топ ТГФҚ қатысуынсыз түзіледі. СН3-тобының көзі болуы үшін метионин АТФ қатысуымен активтенуге түседі. Бұл реакцияның нәтижесінде фосфор қышқылының барлық үш қалдығы да бөлінеді, ал аденозин метиониндегі күкірт атомына байланысады. В результате этой реакции от АТФ отщепляются все три остатка фосфорной кислоты, а аденозин присоединяется к атому серы метионина. Осы жолмен метиониннің активті формасы S- аденозил-метионин түзіледі.
S-аденозил-метионин трансметилдену реакцияларына қатысады. Олардың ішіндегі маңыздысы фосфатидилэтаноаминнен фосфатидилхолинді синтездеуге, биогендік аминдерді О-метилтрансфераза қатысында залалсыздандыруға, норадреналиннен адреналинді синтездеуге, холин және ацетил-КоА-дан ацетилхолинді синтездеуге, креатин синтезіне қатысуы. Кратин креатинфосфат түрінде макроэргиялық байланыстардың резервтік формасы болып табылады және жүйке ұлпасы мен жұмыс істеуші бұлшықетті АТФ-пен қамтамассыз етеді.
Креатиннің синтезі.
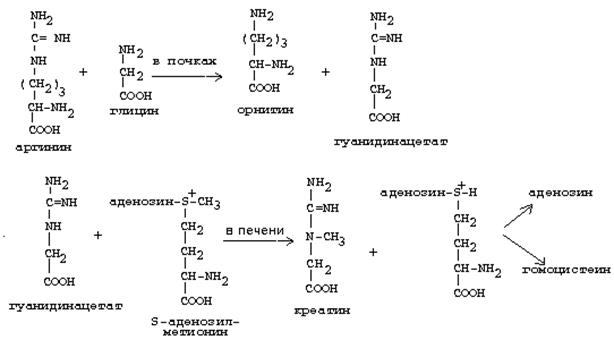
Креатиннің синтезіне басқа да аминолқышқылдар - аргинин және глицин қатысады. Бүйректерде аргининнен және глициннен гуанидинацетат түзіледі, ол бауырда S-аденозил-метионин қатысуымен метилденеді және нәтижесінде креатин түзіледі.
Гомоцистеин
Гомоцистеин - аминқышқыл цистеиннің (гомоцистеин + серин) синтезіне қатысады. Креатин АТФ қатысуымен фосфорлануға түседі, нәтижесінде макроэргиялық байланысы бар қосылыс –креатинфофат түзіледі. Бұл қайтымды реакция фермент креатинфосфокиназа (КФК) арқылы катализденеді.
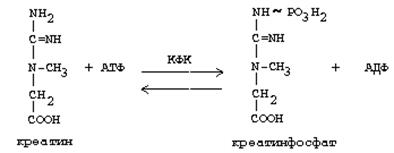
Бұл реакция бұлшықеттерде интенсивті өтеді, негізінен, жүрек бұлшықетінде және ми ұлпасында. Креатинфосфат тыныштық жағдайында активті синтезделеді және бұлшықет жұмысы кезінде ыдырайды. Бұл АТФ регенерациясының біршама жылдам әдісі. Креатинфосфаттан түзілген креатин креатининге дейін ыдырайды, ол соңғы өнім болып табылады және зәр құрамында шығарылады. Тәулігіне 1-2 грамм креатинин шығарылады. Креатининнің бұл мөлшері бұлшықет массасына тікелей пропорционалды, сондықтан ер адамдардың зәріндегі креатин мөлшері әйелдермен салыстырғанда көп болады. Креатинин бірінші ретті зәрден реабсорбтелінбейді, сондықтан екінші реттік зәрдегі оның мөлшері шумақтық сүзілу көлемімен сипатталады.
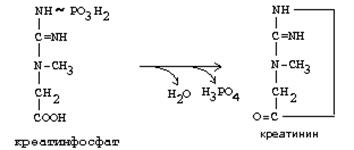
Бұлшықет жасушаларының зақымдалуы кезінде және ми ұлпасының зақымдалуында креатинфосфокиназа қан құрамында байқалады, бұл аталған мүшелердің қызметі бұзылуының диагностикалық белгісі болып табылады. КФК-ның үш изоферменті – кардиалдық, церебралдық, бұлшықеттік болатыны белгілі, олардың қан құрамында кездесуі сәйкес келуші мүшелердің зақымдалғанын анықтауға мүмкіндік береді. Қанда кардиалдық изоферменттің болуы миокард инфарктісінің ерте кездегі диагностикалық белгісі болып табылады.
Цистеиннің алмасуы
Бұл ауыстырылмайтын амноқышқыл, ол сериннен синтезделеді. Сериндегі гидроксилдік топ гомоцистеин беретін SН-тобына ауыстырылуы механизмі арқылы жүреді. Цистеин өзінің SН-тобымен каталиттік орталықты түзіп (тиолдық протеазалар) фермент-белоктардың каталиттік орталығын түзуге қатысады, сонымен бірге белоктардың үшінші және төртінші реттік құрылымдарының қалыптасуына қатысады. Цистеин трипептид глютатионның синтезі үшін қажет, ол цистеин мен глютамин қышқылынан құралған. Глутатион молекуласы шартты түрде (Г-SН) түрінде белгіленеді. Глютатион жеңіл тотығуға және тотықсыздануға қабілетті:
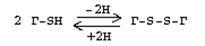
Глютатион тотығып басқа заттарды тотығудан қорғайды, мысалы эритроциттердегі гемоглобиннің қос валентті темірін:

Глютатион НАДФН2 көмегімен фермент глютатионредуктаза қатысуымен тотықсызданады:

Цистеин ыдырауға да түседі, бұл кезде ол тотығады және декарбоксилденеді, соның нәтижесінде таурин түзіледі, ол бауырда жұп өт қышқылдарының (таурохоль және т.б.) түзілуіне қатысады.
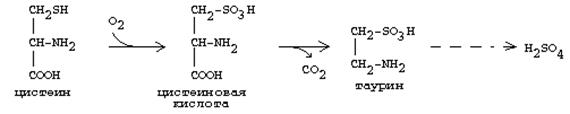
Тауриннен түзілетін күкірт қышқылы, бауырда, улы заттарды залалсыздандыруға қатысады.
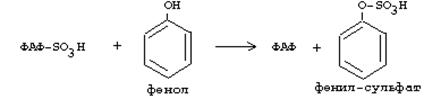
Осы жолдармен белоктардың ішектерде шіру өнімдері - индол, скатол, фенол, крезол заласызданады. Бұл процестерге күкірт қышқылы, өзінің АТФ қатысуымен түзілетін активті формасы 3’-фосфоаденозин-5’-фосфосульфат (ФАФC) түрінде қатысады.
Аргининнің алмасуы
Аргинин – жартылай ауыстырлатын аминоқышқыл. Ол бауырда, аспарагин қышқылы мен орнитиннің қатысуымен мочевина синтезі жолында, карбомоилфосфаттан түзіледі. Аргинин бүйректерде креатиннің синтезіне қатысады, гуанидинацетат түзілгенде гуанидин тобының доноры болу арқылы. Белоктардың құрамында аргинин полярлы оң зарядталған аминоқышқыл ретінде иондық байланыстардың түзілуіне және белоктардың гидраттық қабықтарының қалыптасуына қатысады.
Дикарбондық аминоқышқылдар – глутамин және аспарагин қышқылдарының алмасуы
Бұл аминоқышқылдар көптеген химиялық реакцияларға (жоғарыда келтірілген) қатысады, сондықтан олар аминоқышқылдар алмасуында маңызды роль атқарады.
1. Олар ауыстырылатын аминоқышқылдардың синтезіне қатысады және белоктардың аминоқышқылдық құрамының коррекциясына, бұл ағза жасушасының аминоқышқылдық құрамының коррекциясына қатысады деген болып табылады.
2. Аммиактың және азоттық алмасудың басқа да улы өнімдерінің залалсыздану реакцияларына қатысады.
3. Альфа-кетоқышқылдарға айналу арқылы (альфа-кетоглутарат және қымыздық-сірке қышқылы (ҚСҚ)), олар белоктар, көмірсулар, майлардың алмасуының өзара байланысына да қатысады.
4. Дикарбондық аминоқышқылдар және олардың амидтері (глутамин және аспарагин) жасушаның бүкіл азотқұрамды қосылыстарының синтезделу реакцияларына (нуклеотидтердің, нуклеин қышқылдарының, аминоқанттардың, липидтердің аминдік туындыларының) қатысады. Олар бұл синтезделу реакцияларында азоттың NН2-тобы түріндегі доноры болып табылады немесе оның бүкіл молекуласы қатысады.
Әрбір аминоқышқылдардың жекеленген рольдері:
Глутамин қышқылы
а) тікелей тотығып дезаминденуге түсіп альфа-кетоглутаратты түзеді;
б) трансаминдену реакциясына түседі, оларды спецификалық трансаминазалар катализдейді;
в) глютаминнің синтезі үшін субстрат болады, ол аммиактың тасымалданушы формасы болып табылады және бауырда мочевинаның синтезіне қатысады, сонымен бірге нуклеотидтер мен нуклеин қышқылдарының пуриндік негіздерінің, аминоқанттар мен липидтердің аминдік туындыларының синтезіне қатысады.
г) аминоқышқылдардың жанама дезаминденуіне қатысады;
д) трипептид глютатионның синтезіне қатысады;
е) гамма-аминомай қышқылының түзілуі үшін субстрат болып табылады.
Аспарагин қышқылы
а) трансаминдену реакциясына қатысады;
б) мочевина синтезінде NН2-топтың доноры ретінде болады;
в) пиримидиндік негіздердің синтезінде (бүкіл молекуласымен) және пуриндік негіздердің синтезінде NН2-топтың доноры ретінде;
г) аспарагин синтезіне қатысады.
Екі аминоқышқыл да белоктың үшінші және төртінші реттік құрылымын қалыптастыруға және белоктардың гидраттық қабықтарының қалыптасуына қатысады, себебі полярлы зарядталған аминоқышқылдар болып табылады, сонымен бірге бұл аминоқышқылдар ферменттердің активті орталықтарының қалыптасуына қатысады. Аспарагин және глутамин қышқылдарын амидтендіру аспарагиннің және глутаминнің түзілуіне әкеледі, оларда белок синтезі үшін өте қажет.
3. Тирозин мен фенилаланиннің алмасуы. Аминоқышқылдар алмасуының тұқымқуалаушы бұзылулары.
Фенилаланин ауыстырылмайтын, ал тирозин ауыстырылатын аминоқышқылдар болып табылады.
Фенилаланин ұлпаларда аздаған алмасуларға түседі. Бұл аминоқышқылдың белок молекуласының құрылымына енгізілуінен басқа, денісау адамдағы бір ғана метаболиттік жолы - бұл оның тирозинге спецификалық монооксигеназалық фермент – фенилаланингидроксилаза қатысуымен, микросомалық тотығуға түсіп тирозинге айналуы.
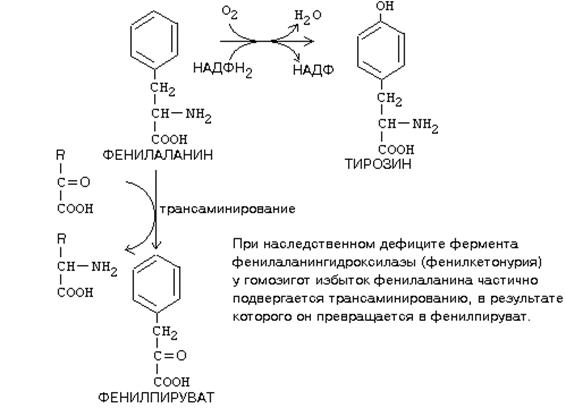
Тирозин әртүрлі ұлпаларда көптеген реакцияларға қатысады. Бұл айналулардың нәтижесінде тирозин тек соңғы өнімдерге дейін ғана ыдырамайды, сонымен бірге аралық метаболиттерді де береді. Олардан көптеген маңызды қосылыстар түзіледі және олардың кейбіреулері биологиялық активті заттар болып табылады.
Тирозиннен түзіледі:
а) бүйрек үстіоердің милы қабатының гормондар - адреналин және норадреналин;
б) тері, шаш, көздің қаршығының қабықшасының пигменттері – меланиндер;
в) қалқанша безінің йодқұрамды гормондар - тироксин және трийодтиронин.
Фенилаланин мен тирозин алмасуларының бұзылулары
Бұл аминоқышқылдардың алмасуларының бұзылулары олардың метаболиттк айналуларын катализдейтін кейбір ферменттердің биосинтезінің бұзылуымен байланысты. Ферменттер синтезінің бұзылуның нәтижесінде тұқымқуалаушы генетикалық аурулар дамиды:
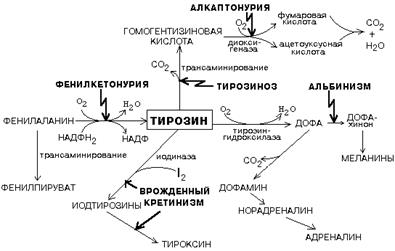
1) фенилкетонурия - фенилаланин-гидроксилаза синтезі бұзылған, сондықтан фенилаланин фенилпируватқа айналады, ол бас миының кейбір бөлімдерінің дамуына уландырушы әсер етеді.
2) альбинизм – ДОФА-ны ДОФА-хромға айналдыратын ферменттердің синтезі бұзылған, сондықтан меланиндердің синтезі бұзылады.
3) алкаптонурия – гомогентизин қышқылының диоксигеназасының синтезі бұзылған, сондықтан зәр қара түске боялады.
4) кретинизм – йодиназа синтезі бұзылған, бұл қалқанша безінің йодқұрамды гормондарының синтезінің бұзылуына әкеледі.
5) тирозиназа ферментінің синтезінің бұзылуы мүмкін, ол тирозинді ДОФА-ға айналдыруды катализдейді, соның нәтижесінде бүйрекүстілердің милы қабаты гормондарының және меланиндердің синтезі бұзылады.
Барлық келтірілген аурулардан, қазіргі кезде, тек фенилкетонурияны ғана емдеуге болады. Ол үшін баланың тағамдық рационынан фенилаланинді алып тастайды және тағамда тирозиннің мөлшерін жоғарлатады. Егер баланы осы диетада 6-7 жасқа дейін ұстайтын болса, онда ақыл-есінің кемшілігі болмайды. Себебі, 6-7 жаста оның бас миының бөлімдері дамып үлгереді, ал ол бас миы ұлпасында фенилпируваттың артық мөлшері кезінде дамымайтын еді..
1. Аминоқышқылдардың декарбоксилденуі. Биогендік аминдер: гистамин, серотонин, гамма-аминомай қышқылы, катехоламиндер, түзілуі және биологиялық қызметі.
Адам ағзасында тек тотығып декарбоксилдену ғана жүреді. Оның ферменттері - декарбоксилазалар. Олардың простетикалық топтары пиридоксальфосфат болып табылады - бұл В6 витаминінің активті формасы. Бұл реакцияның өнімдері – биогендік аминдер және көмірқышқылы газы.
Аминоқышқылдардың декарбоксилденуі реакциясының биологиялық маңызы
1. Реакция қайтымсыз – аминоқышқылдардың қайтымсыз ыдырауына әкеледі.
2. Метаболизмнің соңғы өнімі, ағзадан шығарыла алатын СО2 –нің көп мөлшері түзіледі.
3. Жоғары биологиялық активтілікке қабілетті аминдер түзіледі. Сондықтан бұл аминдерді биологиялық активтілер немесе биогендік аминдер деп атайды. Олар медиатор болып табылады, олардың көмегімен сигналдар бір жасушадан екіншісіне немесе бір молекуладан екіншісіне беріледі.
Декарбоксилаза ферменттерінің субстраттық әсерлесу ерекшеліктері әртүрлі.
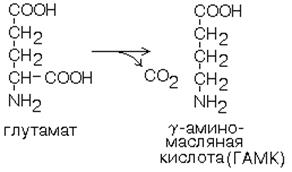
1. Глутаматдекарбоксилаза – жоғарыспецификалық фермент. Бас миының сұр затының жасушаларында қызмет етеді. Глутамин қышқылының гамма-аминомай қышқылына (ГАМҚ) айналуы реакциясын катализдейді.
ГАМК жүйке ижүйесінің тежеуші импульстерінің медиаторы болып табылады. ГАМК және оның аналогтары медицинада нейротроптық зат ретінде эпилепсия және басқа да ауруларды емдеу үшін қолданылады.
2. Орнитиндекарбоксилаза - жоғарыспецификалық фермент. Орнитиннің путресцинге айналуы реакциясын катализдейді:

Путресцин (диаминобутан) өлік уы болып табылады. Путресцинге пропиламин қалдығын қосу нәтижесінде одан спермин және спермидин түзіледі, құрамында 3 (сперминде) немесе 4 (спермидинде) имино- немесе амино топтары болады.
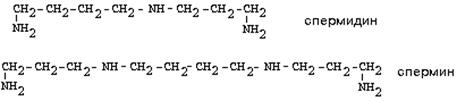
Полиаминдер жасушалардың пролиферациясы прорцестеріне және ұлпалардың өсуіне, сонымен бірге белок биосинтезінің реттелуіне қатысады. Олар кейбір ферменттердің ингибиторлары болып табылады, ионың ішінде протеинкиназалардың да. Спермин және спермидин биогендік полиаминдер тобына жатқызылады. Полиамндерді ағзаға енгізгенде дене температурасы және қан қысымы төмендейді.
Қатерлі ісік ауруларында полиаминдердің секреттелуінің кенет жоғарлайтыны және олардың зәр құрамында экскреттелуі анықталған.
 2015-10-16
2015-10-16 2305
2305







